
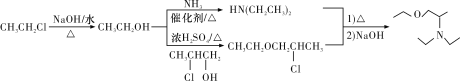
【题目】化合物J是一种常用的抗组胺药物,一种合成路线如下:

已知:①C为最简单的芳香烃,且A、C互为同系物。
②2ROH+NH3![]() HNR2+2H2O(R代表烃基)。
HNR2+2H2O(R代表烃基)。
请回答下列问题:
(1)A的化学名称是______________,H中的官能团名称是________________________。
(2)由D生成E的反应类型是__________,G的结构简式为________________________。
(3)B+C→D的化学方程式为______________。
(4)L是F的同分异构体,含有联苯结构,遇FeCl3溶液显紫色,则L有__________________(不考虑立体异构)种。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的结构简式为______。
(5)写出用氯乙烷和2-氯-1-丙醇为原料制备化合物![]() 的合成路线(其他无机试剂任选) __。
的合成路线(其他无机试剂任选) __。
【答案】甲苯 醚键、氯原子 氧化反应 CH2OHCH2Cl ![]() +
+![]() CH2Cl
CH2Cl![]()
![]() +HCl 19
+HCl 19 ![]()
【解析】
(1)由A→B的反应条件以及B的组成可推知A为甲苯;由H的结构简式可知,H中的官能团为醚键和氯原子;
(2)反应D→E属于去氢加氧的反应,所以其反应类型为氧化反应;由F+G→H的反应条件(浓硫酸、加热)以及产物中醚键的生成可知,该反应属于羟基间的脱水成醚,故G的结构简式为CH2OHCH2Cl;
(3)B为一氯甲苯,C为苯,结合D的结构简式可得B+C→D的化学方程式为![]() +
+![]() CH2Cl
CH2Cl![]()
![]() +HCl;
+HCl;
(4)根据F的分子组成以及L遇FeCl3溶液显紫色,说明分子中有一个酚羟基和一个甲基,相当于用一个酚羟基和一个甲基分别取代联苯中的两个氢原子,可以用定一移一的方法分析。先用一个酚羟基取代联苯中一个氢的位置,可得三种结构,分别为![]() 、
、![]() 、
、![]() ,这三种结构中苯环上氢的种数分别为7种、7种、5种,说明甲基的取代位置有19种,即L可能的结构有19种。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的分子结构应该对称,结构简式为
,这三种结构中苯环上氢的种数分别为7种、7种、5种,说明甲基的取代位置有19种,即L可能的结构有19种。其中核磁共振氢谱为六组峰,峰面积之比为3∶2∶2∶2∶2∶1的分子结构应该对称,结构简式为![]() ;
;
(5)先观察目标产物的结构特点,发现目标产物与合成路线中J物质所含官能团相同,所以应结合题干中F→H→J的合成路线找出所需的反应物为HN(CH2CH3)2、乙醇和2-氯-1-丙醇,其中2-氯-1-丙醇为原料,乙醇可以由氯乙烷水解得到,HN(CH2CH3)2可由乙醇和氨反应得到(已知条件②),再按F→H→J的过程合成目标产物,合成路线为 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是___________(用编号填写)
a.CH3COONab.Na2CO3 c.NaClOd.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_________(填字母)
A.c(H+) B.![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:___________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=________(填准确数值).
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)图I是实验室制取蒸馏水的常用装置,图中明显的错误是_________________。
(2)仪器A的名称是_____________,仪器B的名称是______________。
(3)实验时A中除加入少量自来水外,还需加入少量__________,其作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6·3H2O]可用作食盐添加剂,一种制备黄血盐的工艺如下所示:

下列说法错误的是
A. HCN溶液有剧毒,含CN-的废水必须处理后才能排放
B. “废水”中含量较多的溶质为CaCl2
C. “试剂 X”可能是K2CO3
D. “系列操作”为蒸发结晶、过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯
取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。可利用亚硝酸与叔丁醇(t-BuOH)在40 ℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:________________。
(2)制备叠氮化钠(NaN3)
按如图所示组装仪器(加热装置略)进行反应,反应方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。

①装置a的名称是________________;
②该反应需控制温度在65 ℃,采用的实验措施是____________________;
③反应后溶液在0 ℃下冷却至有大量晶体析出后过滤,所得晶体使用无水乙醇洗涤。试解释低温下过滤和使用无水乙醇洗涤晶体的原因是______________________________________________。
(3)产率计算
①称取2.0 g叠氮化钠试样,配成100 mL溶液,并量取10.00 mL溶液于锥形瓶中。
②用滴定管加入0.10 mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00 mL[发生的反应为2(NH4)2Ce(NO3)6+2NaN3===4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑](假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00 mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。计算可知叠氮化钠的质量分数为__________(保留2位有效数字)。若其他操作及读数均正确,滴定到终点后,下列操作会导致所测定样品中叠氮化钠质量分数偏大的是______(填字母代号)。
A.锥形瓶使用叠氮化钠溶液润洗
B.滴加六硝酸铈铵溶液时,滴加前仰视读数,滴加后俯视读数
C.滴加硫酸亚铁铵标准溶液时,开始时尖嘴处无气泡,结束时出现气泡
D.滴定过程中,将挂在锥形瓶壁上的硫酸亚铁铵标准液滴用蒸馏水冲进瓶内
(4)叠氮化钠有毒,可以使用次氯酸钠溶液对含有叠氮化钠的溶液进行销毁,反应后溶液碱性明显增强,且产生无色无味的无毒气体,试写出反应的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是两种气态烃组成的混合气体完全燃烧所得的CO2和H2O的物质的量(单位:mol)的变化关系。下列判断不正确的是:
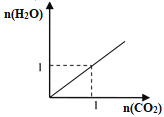
A. 一定含有甲烷
B. 可能含有乙烷
C. 可能含有乙炔
D. 若120℃不变,反应前后气体体积不一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”,则活化氮开始向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
Ⅰ. 氮的活化
工业合成氨是氮的活化重要途径之一,在一定条件下,将N2 和 H2 通入到体积为0.5L的恒容容器中,反应过程中各物质的物质的量变化如图所示:

(1)10min内用NH3表示该反应的平均速率,v(NH3)=____________。
(2)在第10min和第25min改变的条件可能分别是_________、________(填字母)。
A.加了催化剂 B. 升高温度 C. 增加NH3的物质的量
D.压缩体积 E.分离出氨气
(3)下列说法能说明该可逆反应达到平衡状态的是__________(填字母)。
A. 容器中气体密度不变 B. 容器中压强不变
C. 3v(H2)正=2v(NH3)逆 D. N2、H2、NH3分子数之比为1∶3∶2
Ⅱ.催化转化为惰性氮 已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(4)在250C、101KPa时,N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol.
2NH3(g) △H1= -92.4kJ/mol.
2H2(g)+O2(g)=2H2O(l) △H2= -571.6 kJ/mol
N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式______________________________。
(5)在有氧条件下,新型催化剂M能催化CO与NOx反应生成N2。现向某密闭容器中充入等物质的量浓度的NO2和CO气体,维持恒温恒容,在催化剂作用下发生反应:
4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H<0,相关数据如下:
N2(g)+4CO2(g) △H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) /mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) /mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①计算此温度下的化学平衡常数K=______,
②实验室模拟电解法吸收NOx装置如图,(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验(a<b),电解时NO2发生反应的电极反应式:_________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为_________,电子排布式是________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_______。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式________________。
(3)与B一个周期的元素Be和C,它们的电离能由小到达的顺序 _______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com