
| 8.4 |
| 3 |
| 9.6 |
| 2 |
| 8.4 |
| 3 |
| 9.6 |
| 2 |
| 12 |
| 7 |
| 48 |
| 3 |


 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
| A、NaHSO3和NaHCO3的中性混合溶液中(S和C均用R表示):c(Na+)=c(HRO3-)+2c(RO32-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② |
| D、等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N前<N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
| B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3?H2O+H2O |
| C、在溴化亚铁溶液中通入过量的氯气:Cl2+2Fe2++2Br-═2Fe3++2Cl-+Br2 |
| D、过量CO2通入氢氧化钠溶液中:CO2+OH-═HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 用惰性电极按如图中装置完成实验,其中A、B两烧杯分别盛放200g 10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯溶液中NaOH的质量分数为10.23%,试回答:
用惰性电极按如图中装置完成实验,其中A、B两烧杯分别盛放200g 10% NaOH溶液和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯溶液中NaOH的质量分数为10.23%,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba(OH)2与MgSO4反应:Mg2++2OH-═Mg(OH)2↓ |
| B、铜片插入到硝酸银溶液中:Cu+Ag+═Cu2++Ag |
| C、硫酸铝溶液与氯化钡溶液混合:Ba2++SO42-═BaSO4↓ |
| D、碳酸钙溶于稀醋酸中:CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、62 g Na2O与78gNa2O2中所含阴离子的个数比为1:2 |
| B、质量相等的两份气体,一份是SO2,另一份是SO3,这两份气体中,SO2与SO3所含氧原子个数之比是6:5 |
| C、在标准状况下,0.5NA个水分子所占体积是11.2 L |
| D、500 mL 1 mol/L Fe2(SO4)3溶液,同250 mL 3 mol/L的Na2SO4溶液所含硫酸根离子的物质的量浓度之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
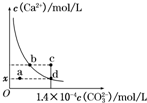 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9 mol2/L2,下列说法不正确的是( )
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10-9 mol2/L2,下列说法不正确的是( )| A、x数值为2×10-5 |
| B、c点时有碳酸钙沉淀生成 |
| C、加入蒸馏水可使溶液由d点变到a点 |
| D、b点与d点对应的溶度积相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com