
(10分)在容积为1 L的密闭容器中,进行如下反应:
A(g)+2B(g)  C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。

请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_______。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变 B.混合气体中c(A)不变
C.v正(B)=2v逆(D) D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算在800℃时的平衡常数K=__________,该反应为__________反应(填“吸热”或“放热”)。
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应__________(填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
(10分,每空2分)
(1) 0.18 mol/(L·min)
(2) ABC
(3) 0.9;吸热
(4) 向正方向进行
【解析】
试题分析:(1) 700℃时,0~5min内,以D表示的平均反应速率为0.45mol/1L/5min=0.09 mol/(L·min),根据化学计量数,以B表示的平均反应速率为0.18 mol/(L·min);(2)反应是一个体积减小的气体参加的反应,A、容器中压强不变时达平衡状态;B.混合气体中c(A)不变时达平衡状态;C、v正(B)=2v逆(D),正逆反应速相等,达平衡状态;D、c(A)=c(C),不能说明达平衡状态;答案选ABC;(3)在800℃时,达到平衡状态D的物质的量为0.6mol,由三行式可知,C的物质的量为0.6mol,A的物质的量为0.4mol,B的物质的量为1.0mol,所以平衡常数K=(0.6mol/L)2/[0.4mol/L×(1.0mol/L)2]=0.9;温度升高,D的物质的量增加,平衡向正反应方向移动,该反应为吸热反应;(4) 800℃时,浓度积Q=(0.20 mol/L×0.018 mol/L)/[0.06 mol/L×(0.50 mol/L)2]=0.24,Q<K,则此时该反应向正方向进行。
考点:化学平衡、化学反应速率


科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
某化合物结构简式为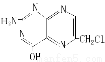 ,下列关于其说法正确的是
,下列关于其说法正确的是
A.分子中碳原子与氮原子的个数比是7∶5
B.属于芳香族化合物
C.能与氢氧化钠溶液反应,但不能与盐酸反应
D.属于苯酚的同系物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:填空题
(16分)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。工艺流程如下(部分操作和条件略):

已知:一定条件下,MnO4 可与Mn2+反应生成MnO2
可与Mn2+反应生成MnO2
(1)稀H2SO4溶解Al2O3的离子方程式是__________________。
(2)已知:生成氢氧化物沉淀的pH如下表(注:金属离子的起始浓度为0.1mol·L-1)

上述流程中,加入过量KMnO4溶液的作用是________________________。(用离子方程式表示)
(3)向滤渣B中加入浓盐酸并加热,能说明沉淀中存在MnO2现象是____________。
上述流程中加入MnSO4体的目的是________________________。
操作a由一系列操作组成,分别是________、________、过滤。
(4)若用沉淀溶解平衡原理分析,操作a能析出A12(SO4)3·18H2O的原因是①____________②___________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省曲阜市高三上学期期中考试化学试卷(解析版) 题型:选择题
1.92g铜投人一定盆的浓HNO3中、铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下672mL气体。将盛有此气休的容器倒扣在水中.通入标准状况下一定体积的氧气恰好使气体完全被水吸收生成硝酸。则通入O2的体积是
A.504mL B.336mL C.224mL D.168mL
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省曲阜市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关物质的性质和应用的说法均正确的是
A.二氧化硅能与NaOH溶液反应,不能用玻璃瓶盛放NaOH溶液
B.Cl2能与Ca(OH)2反应,可以用澄清石灰水吸收尾气中的Cl2
C.CaCO3、BaSO4都难溶于水,均可用做钡餐
D.Al与Fe2O3能发生铝热反应,可用于焊接钢轨
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:填空题
(3分)下列有关实验的叙述中,合理的是
A.用碱式滴定管量取25.00mL溴水
B.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
C.测定溶液的pH值时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较
D.圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上
E.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏高
F.配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
下列有关说法正确的是(NA为阿伏加德罗常数)
A.1.00molNaCl中含有NA个NaCl分子
B.欲配制1.00L,1.00mol.L-1的NaCl溶液,可将 58.5gNaCl溶于 1.00L水
C.1.12L Cl2含有1.7NA个质子
D.1molCl2与足量的铁反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三12月学情调研化学试卷(解析版) 题型:填空题
(12分)酸浸法制取硫酸铜的流程示意图如下

(1)步骤①中Cu2(OH)2CO3 发生反应的化学方程式为 。
(2)在步骤③发生的反应中,1mol MnO2转移2mol 电子,该反应的离子方程式为 。
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取4.800 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
b.量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定
(反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
c.量取25.00 mL溶液A,加入足量的NaOH溶液充分反应后,过滤、洗涤、灼烧得红色粉末0.600g。
d.另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165 g。
①用Na2S2O3溶液进行滴定时,滴定到终点的颜色变化为 。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省五市十校教研教改共同体高三第一次联考化学试卷(解析版) 题型:填空题
(13分)铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:

(1)操作a的名称为 。
(2)在浸取过程中浓盐酸与Fe2O3的离子方程式 。
(3)写出加入30%H2O2过程中发生的离子反应方程式: 。
(4)加入Pb(NO3)2沉淀CrO42-时,检验沉淀是否完全的方法是 。
(5)在废液中加入10%明矾溶液发生反应的离子方程式为 。
(6)由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,将含Cr2O72-的酸性废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72
 -发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
①请分析电解过程中溶液pH不断上升的原因 。
②当电路中通过3mol电子时,理论上可还原的Cr2O72-的物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com