
| A. | 只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 | |
| B. | 用澄清石灰水鉴别Na2CO3、NaHCO3两种溶液 | |
| C. | 用萃取分液的方法除去酒精中的水 | |
| D. | 用可见光束照射以区别溶液和胶体 |
分析 A.氨水与氯化钠、硫酸钠不反应;
B.澄清石灰水与Na2CO3溶液和NaHCO3溶液反应均生成白色沉淀;
C.酒精和水混溶;
D.胶体具有丁达尔现象区别于溶液.
解答 解:A.氨水与氯化钠、硫酸钠不反应,与AlCl3、MgCl2反应生成白色沉淀,故A错误;
B.澄清石灰水与Na2CO3溶液和NaHCO3溶液反应均生成白色沉淀,现象相同,不能鉴别,故B错误;
C.酒精和水混溶不能分层,不能萃取分液,故C错误;
D.胶体具有丁达尔现象区别于溶液,用可见光束照射以区别溶液和胶体,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重元素化合物知识、物质鉴别及反应现象的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cl2的水溶液可以导电,说明Cl2是电解质 | |
| B. | 某溶液中加入硝酸酸化的氯化钡溶液有白色沉淀生成说明溶液中一定含有SO42- | |
| C. | 向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 | |
| D. | 切开金属钠暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
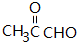 .
.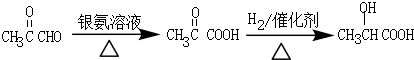 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可与FeCl3溶液发生显色反应 | |
| B. | 分子中最少有4个碳原子共平面 | |
| C. | 能发生取代反应和银镜反应 | |
| D. | 与H2完全加成的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 3 | C. | 5 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com