
| A. | 磷(P)基态原子最外层轨道表示式: | |
| B. | 钢铁发生吸氧腐蚀的正极反应式: O2+4H++4e-═2H2O | |
| C. | 葡萄糖的实验式:C6H12O6 | |
| D. | 氰基的电子式: |
分析 A.P原子的最外层有5个电子,3s轨道上有2个电子,3p轨道上有3个电子;
B.吸氧腐蚀中,正极氧气得到电子生成氢氧根离子;
C.C6H12O6为葡萄糖的分子式,不是实验式;
D.氰基中含有1个C≡N键,碳原子最外层为7个电子,N原子最外层为8个电子.
解答 解:A.磷(P)基态原子的最外层有5个电子,3s轨道上有2个电子,3p轨道上有3个电子,其正确的轨道表示式为: ,故A错误;
,故A错误;
B.钢铁发生吸氧腐蚀的正极氧气得到电子生成氢氧根离子,正确的反应式为:O2+2H2O+4e-═4OH-,故B错误;
C.实验式为分子中各原子的最简比,则葡萄糖的实验式为CH2O,故C错误;
D.氰基为中性原子团,含有1个C≡N键,其电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、轨道排布式、实验式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
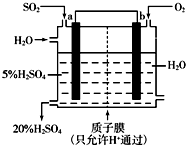 在硫酸工业中,SO2转化为SO3是一个关键步骤
在硫酸工业中,SO2转化为SO3是一个关键步骤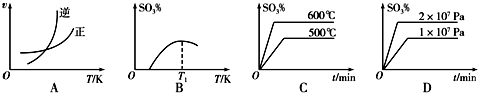
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 过氧化氢的电子式
过氧化氢的电子式
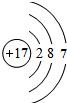 ,其最高价氧化物对应的水化物的化学式为HClO4.
,其最高价氧化物对应的水化物的化学式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
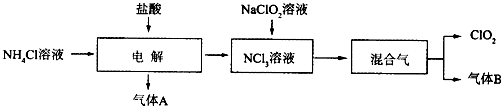
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯和氯水是同一物质 | |
| B. | 红磷在氯气中燃烧产生红色烟雾 | |
| C. | 氯气与水的反应中氯是氧化剂,水是还原剂 | |
| D. | 用氯制漂白粉是为了得到易贮存的漂白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4→HCl→NaOH→CO2 | B. | Na2SO4→NaCl→NH3•H2O | ||
| C. | NaCl→Na2SO4→NaOH | D. | Na2SO4→NaCl→NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据氧化还原反应的规律,推出强氧化剂遇到强还原剂一定会发生氧化还原反应 | |
| B. | 根据化学反应的规律,推出氢氧化铁可通过化合反应得到 | |
| C. | 根据元素的非金属性较强,其单质也越活泼规律,推出磷单质比N2稳定得多 | |
| D. | 根据CO2通入Ba(NO3)2溶液中无沉淀的规律推测,SO2入Ba(NO3)2溶液中也无沉淀产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com