
【题目】下列对生活中有关化学问题的分析正确的是( )
A.钙和磷都是人体内含量丰富的矿物元素,它们都属于微量元素
B.垃圾焚烧和发电技术的结合,既解决了污染问题,又有效利用了垃圾所含的能量
C.制造普通玻璃的主要反应原理之一为:CaO+SiO2 ![]() =CaSiO3
=CaSiO3
D.青霉素是最早发现的天然抗生素,其中起治疗作用的是水杨酸
科目:高中化学 来源: 题型:
【题目】从海带中提取碘单质,成熟的工艺流程如下:干海带 ![]() 海带灰
海带灰 ![]() 悬浊液
悬浊液 ![]() 滤液
滤液 ![]() 碘水
碘水 ![]() I2的CCl4
I2的CCl4
溶液 ![]() I2下列关于海水制碘的说法正确的是( )
I2下列关于海水制碘的说法正确的是( )
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I﹣的滤液中加入稀硫酸和双氧水后,碘元素发生还原反应
C.在碘水中加入几滴淀粉溶液,溶液出现蓝色沉淀
D.碘水加入CCl4得到I2的CCl4溶液,该操作为萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组用如图装置制取Cl2 , 证明产生的气体中含有HCl. 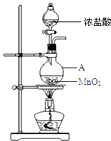
(1)仪器A的名称为;A中反应的离子方程式为;
(2)甲同学将A中产生的气体通入如表溶液:
实验序号 | 试剂 | 现象 |
a | 紫色石蕊溶液 | |
b | AgNO3溶液 | 出现白色沉淀 |
①实验a中的现象为;
②不能证明产生的气体中含有HCl的实验是(填字母序号);
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因;
(4)已知:2S2O32﹣+I2═S4O62﹣+2I﹣ . 丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2 . 取25.00mL溶液X,加入过量KI溶液,然后用0.04molL﹣1 Na2S2O3溶液滴定生成
的I2 , 达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl﹣ , 再用0.10molL﹣1 AgNO3溶液滴定所得溶液中的Cl﹣ .
①X中的HClO不会影响I的测定结果,原因是;
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10molL﹣1 AgNO3溶液的体积应大于mL(用含V的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺 酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( ) 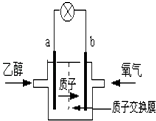
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池工作时,1mol乙醇被还原时就有6mol电子转移
D.电池正极的电极反应为:4H++O2+4e﹣→2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平的两盘中各放一只盛有足量稀硫酸的烧杯,保持天平平衡。若分别向两烧杯中加入2.3 g 钠和铁,待反应完全后,天平两盘( )
A. 仍平衡 B. 盛钠的一端下沉
C. 盛铁的一端下沉 D. 不能判断天平的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下将l0mL c(H+)=0.00lmol/L的醋酸溶液加水稀释10倍后,下列说法正确的是( )
A. 醋酸的电离程度增大,c(H+)亦增大
B. 溶液中 不变
不变
C. 溶液中导电粒子的数目增多
D. 再加入l0mL c(OH-)=0.00lmol/L的NaOH溶液,混合液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.稀有气体元素化学性质不活泼,最外层电子数均为8
B.除短周期外,其他周期均有18种元素
C.副族元素没有非金属元素
D.碱金属元素是指第ⅠA族的所有元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷的重要化合物NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得。室温下,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如下图所示。
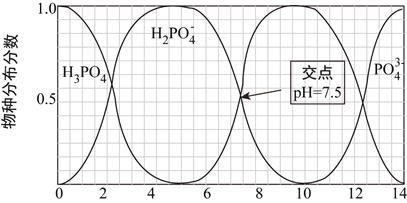
下列说法中正确的是( )
A. 电离方程式:H3PO4=3H++PO43-
B. pH=7时存在c(Na+)=c(H2PO4-)+c(HPO42-)
C. 向Na3PO4溶液中加入NaH2PO4溶液,不会发生化学反应
D. 相同温度和浓度下,H2PO4-的电离能力弱于HPO42-的水解能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化铝锂(LiAlH4)是有机合成中的重要还原剂。某课题组设计实验制备氢化铝锂并测定其纯度。已知: 氢化铝锂、氢化锂遇水都剧烈反应并产生同一种气体。
I.制备氢化锂
选择图I中的装置制备氢化锂(有些装置可重复使用):
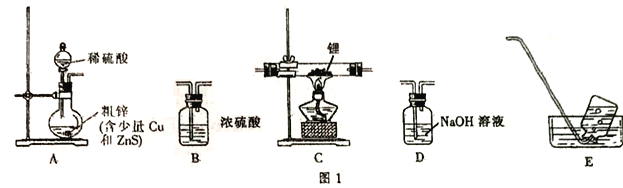
(1)装置的连接顺序(从左至右)为A→______________。
(2)检在好装蹬装置的气密性,点燃酒精灯前需进行的实验操作是_______________。
(3)写出制备氢化铝锂的化学方程式:__________________。
II. 制备氢化铝锂
1947年,Schlesinger,Bond和Finholt首次制得氢化铝锂,其方法是使氢化锂与无水三氯化铝按一定比例在乙醚中混合,搅样,充分反应后,经一系列操作得到LiAlH4晶体。
(4)写出氢化锂与无水三氯化铝反应的化学方程式:____________________。
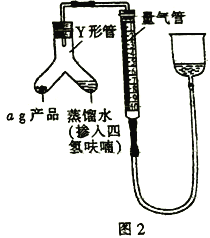
III.测定氢化铝锂产品(不含氢化锂)的纯度
(5)按图2装配仪器、检查装置气密性并装好药品(Y形管中的蒸馏水足量,为了避免氢化铝锂遇水发生爆炸,蒸馏水中需掺入四氢呋喃作稀释剂),启动反应的操作是________。读数之前上下移动量气管右侧的容器,使量气管左、右有两侧的液面在同一水平面上,其目的是_________。
(6)在标准状况下,反应前量气管读数为V1mL,反应完毕并冷却之后,量气管读数为V2mL。该样品的纯度为_____________(用含a、V1、V2的代数式表示)。如果起始读数时俯视刻度线,测得的结果将________(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com