
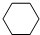
 ,名称是环己烷.
,名称是环己烷.分析 根据C元素、H元素守恒确定该烃的分子式为C6H12;
该烃的分子式为C6H12,不饱和对为1,若该烃不能使溴水或高锰酸钾溶液褪色,说明烃中苯环不饱和键,该烃为环烷烃,
其一溴取代物只有一种,说明分子中只有一种H原子,该烃为环己烷;
若该烃能使溴水褪色,说明分子中含有1个C=C双键,该烃属于烯烃,在催化剂作用下与H2发生加成反应,生成2.2-二甲基丁烷,则该烃的结构简式为(CH3)C-CH=CH2.
解答 解:0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则n(C)=n(CO2)=0.6mol、n(H)=2n(H2O)=1.2mol,1mol该烃中含有C、H的物质的量分别为:n(C)=$\frac{0.6}{0.1}$mol=6mol,n(H)=$\frac{1.2}{0.1}$mol=12,该烃的分子式为:C6H12;若该烃不能使溴水或高锰酸钾溶液褪色,则分子中不存在碳碳双键,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃只能为环己烷,环己烷的结构简式为: ,
,
若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,则该有机物分子中含有碳碳双键,属于烯烃,与氢气发生加成反应生成2.2-二甲基丁烷:CH3C(CH3)2CH2CH3,向2,2-二甲基丁烷的碳架上添加碳碳双键,只有一种添加方式,则该烯烃的结构简式为(CH3)3C-CH=CH2,该有机物的名称为:3,3-二甲基-1-丁烯,该加成反应的化学方程式为(CH3)3C-CH=CH2+H2$\stackrel{一定条件}{→}$(CH3)3C-CH2CH3,
故答案为:C6H12;环烷; ;环己烷;烯;(CH3)3C-CH=CH2;3,3-二甲基-1-丁烯;(CH3)3C-CH=CH2+H2$\stackrel{一定条件}{→}$(CH3)3C-CH2CH3,
;环己烷;烯;(CH3)3C-CH=CH2;3,3-二甲基-1-丁烯;(CH3)3C-CH=CH2+H2$\stackrel{一定条件}{→}$(CH3)3C-CH2CH3,
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握常见有机物的结构与性质,明确相同的命名原则及确定有机物分子式的方法.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔化时不导电 | |
| B. | 不是离子化合物,而是极性共价化合物 | |
| C. | 水溶液的导电能力很差 | |
| D. | 溶液中溶质分子和溶质电离出的离子共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2是氧化产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | H2C2O4的氧化性强于ClO2的氧化性 | |
| D. | ClO2作水处理剂时,利用了其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
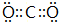 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 由于受3d电子的影响,元素周期表中第四周期过渡元素的明显特征是形成多种多样的配合物.
由于受3d电子的影响,元素周期表中第四周期过渡元素的明显特征是形成多种多样的配合物. 分子内的作用力没有B (填编号).
分子内的作用力没有B (填编号).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol H2与0.5mol H2和O2的混合物所含的原子数目相同 | |
| B. | 32g O2含有6.02×1023个氧分子 | |
| C. | 1mol H2O中含有2mol H2,1mol O,总共所含电子的物质的量为10mol | |
| D. | 物质的量为1mol 的任何微粒的质量与NA个该种微粒的质量在任何情况下都相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com