
【题目】下列实验误差分析错误的是( )
A.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B.排水量气,左右液面相平后,未冷却到室温立即读数,所得气体的体积偏大
C.称取2.3gNaCl固体,砝码放在托盘天平的左边,所称量固体药品质量偏小
D.用量筒量取5.0mL浓硫酸,仰视读数,所得到浓硫酸的体积偏大
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 实验室中常用排饱和食盐水的方法收集Cl2
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 升高温度能够促进水的电离
D. 在含有Fe(SCN)3的红色溶液中加少量铁粉,振荡静置,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室如何制取Fe(OH)3胶体,请简述操作___,相应的化学方程式是____。
(2)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是____。
(3)除去胶体中混有的FeCl3和HCl的方法是___,如何验证胶体已净化完全,请简述方法___。
Ⅱ.已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为____mol·L-1(保留小数点后一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=____mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液。下面操作造成所配溶液浓度偏高的是___(填序号)。
A.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留
B.向容量瓶加水定容时眼睛俯视液面
C.烧杯溶解固体后,用蒸馏水润洗2-3次,将部分洗涤液转入容量瓶中
D.定容摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应,符合该图的是( )
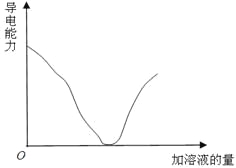
A.Ba(OH)2溶液中滴加稀H2SO4B.NaOH溶液中滴加稀HCl
C.CH3COOH溶液中滴加KOH溶液D.Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。

(1)调整天平零点时,若指针偏向右边,应将左边的螺丝____________(填“向左”或“向右”)旋动。
(2)滴加NaOH溶液,生成沉淀的离子方程式为_______________________________。
(3)加热蒸发过程中要用到玻璃棒,其作用是_________________________________。
(4)洗涤该沉淀的方法是______________________________________________________,为了检验此沉淀是否洗涤干净,应取最后一次的洗涤液少许,加入__________溶液检验。
(5)若向CuSO4溶液中滴加了100mLNaOH溶液,则NaOH溶液的物质的量浓度至少为_________。
(6)理论上最多可以制得CuO的质量为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)该反应的氧化剂是___(填化学式);氧化产物与还原产物的物质的量比是___;如果反应生成0.3mol的单质碘,则转移的电子数目是___。
(2)先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置,这时候,观察到的现象是___;
(3)若采用如图实验装置将四氯化碳和I2的混合溶液分离。

写出图中仪器的名称:①___;该装置还缺少的仪器是___;
(4)上面实验中用到一定物质的量浓度的稀硫酸,在配制稀硫酸溶液的过程中,下面操作造成所配稀硫酸溶液浓度偏高的是___。
A.溶解的时候溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
D.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,PH相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO-)________ c(HCO3-)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________(填代号)
a.向NaClO溶液中加适量的水 b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水 d. 向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
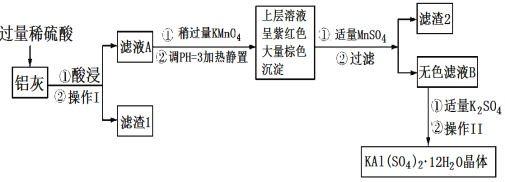
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com