
【题目】在铜、锌、稀硫酸构成的原电池中(如图所示)
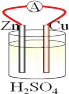
(1)负极是__________(填“铜”或“锌”),_________电子(填“失去”或“得到”),发__________(填“氧化”或 “还原”),电极反应方程式______________;
(2)电流由__________流向__________(填“铜”或“锌),铜片上观察到的现象是________________。
【答案】锌 失去 氧化 Zn-2e-=Zn2+ 铜 锌 铜片表面有气泡产生
【解析】
锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,铜为正极,正极上氢离子得电子发生还原反应,电子从负极流向正极,阳离子从负极移向正极,以此解答。
(1)Zn、Cu、H2SO4构成原电池,由于金属活动性Zn>Cu,所以Zn为原电池的负极,失去电子,被氧化,发生氧化反应,负极的电极反应式为Zn-2e-=Zn2+;
(2)铜为正极,溶液中的H+在正极上得电子发生还原反应,2H++2e-=H2↑,会看到正极Cu片上不断产生气泡。电子从负极流向正极,阳离子从负极移向正极,由于电流方向为正电荷移动方向,所以电流从正极Cu经外电路流向负极Zn。


科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
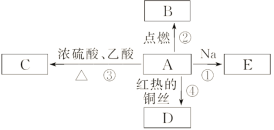
(1)写出A的结构简式:______________________,其官能团名称为__________。
(2)下列反应的化学方程式:
反应①:____________________________________________;
反应③:___________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d、e的原子序数依次增大。a的简单阴离子与锂离子具有相同的电子层结构,b原子最外层电子数等于内层电子数的2倍。d的单质与稀盐酸剧烈反应放出a2。在1L0.2mol·L-1a2e的水溶液中缓慢通入ec2气体,该溶液的pH与ec2气体体积(标准状况)的关系如图所示。下列说法不正确的是
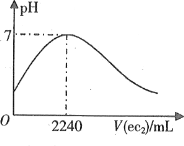
A.a和b可构成所有原子共平面的分子
B.在b、c、e的气态氢化物中,c的最稳定
C.d的氯化物一定能破坏水的电离平衡
D.e的最高价含氧酸与其氢化物可能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是()
A.黄绿色的氯水光照后颜色变浅
B.红棕色的二氧化氮加压后颜色先变深再变浅
C.合成氨工业使用催化剂提高氨的产量
D.工业上生产硫酸的过程中,使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料在日常生活、生产中有着广泛的运用,下列关于金属的说法不正确的是
A.工业上金属Mg、Al都是用电解熔融的氯化物制得的
B.合金的性质与其成分金属的性质不完全相同
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积均为2L的甲乙丙三个恒容密闭容器中均加入0.10mol/L的N2、0.26mol/L的H2,进行合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol。图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数。
2NH3(g) △H=-92.4kJ/mol。图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数。
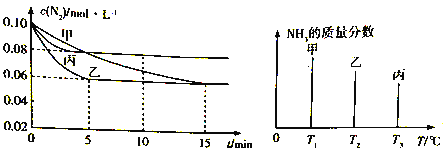
下列判断不正确的是
A. 图2 中反应速率最快的是容器丙
B. 图1 中容器乙的反应可能使用了催化剂
C. 图l 中容器乙0~5 min时间内v(N2) = 0.012mol/(L·min)
D. 图1 中容器丙内反应的平衡常数为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下某体积一定的密闭容器中发生的反应aA(g)+bB(g)![]() xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指

A. 平衡混合气的密度
B. 平衡混合气中B的百分含量
C. 平衡混合气的总物质的量
D. 平衡混合气的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中进行反应:3SiCl4(g)+2N2(g)+6H2(g) ![]() Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
Si3N4(s)+12HCl(g)能表示上述反应达到化学平衡状态的是
A.v逆(N2)=3v正(H2)
B.v正(HCl)=4v正(SiCl4)
C.混合气体密度保持不变
D.c(N2) :c(H2) :c(HCl)=1:3:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】神舟十一号飞船搭乘CZ—2F火箭成功发射,在重达495吨的起飞重量中,95%的都是化学推进剂。
(1)CH3OH和液氧是常用的液体火箭推进剂。
①已知:
CO2(g)+3H2(g)CH3OH(g)+H2O(l) ΔH1
2H2(g)+O2(l)=2H2O(l) ΔH2
CH3OH(g)=CH3OH(l) ΔH3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l) ΔH4
则ΔH4=______(用ΔH1、ΔH2、ΔH3来表示)。
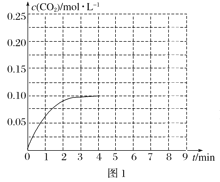
②某温度下,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1molCH3OH和1molH2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数______(保留四位有效数字)。保持其他条件不变,在第5min时向体系中再充入0.2molCO2和0.4molH2,第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图1中画出5~9min的c(CO2)变化曲线示意图_______。
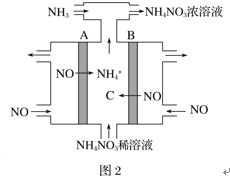
(2)NH4NO3也是一种重要的固体推进剂,可通过电解NO制备NH4NO3,其工作原理如图2所示,A电极的名称为______极,请写出在B电极上发生的电极反应式:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com