
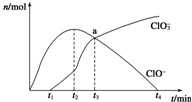
 工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO).一化学小组模拟实验得到ClO-、ClO${\;}_{3}^{-}$等离子其物质的量(mol)与反应时间t(min)的关系曲线:
工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO).一化学小组模拟实验得到ClO-、ClO${\;}_{3}^{-}$等离子其物质的量(mol)与反应时间t(min)的关系曲线:分析 (1)工业制取漂白液:Cl2和NaOH反应生成NaCl、NaClO和H2O;
(2)a点含有溶质NaCl、NaClO、NaClO3,其中c(ClO-)=c(ClO3-),发生反应:4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O,次氯酸根离子发生水解,溶液显碱性;
(3)次氯酸根离子发生水解,显碱性,越稀越水解,据此回答;
(4)由图可知,ClO3-浓度增大,ClO-浓度减小,结合电子转移守恒,可能是ClO-发生歧化反应生成Cl-、ClO3-.
解答 解:(1)工业制取漂白液的原理方程式:Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(2)a点含有溶质NaCl、NaClO、NaClO3,其中c(ClO-)=c(ClO3-),发生反应:4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O,次氯酸根离子发生水解,溶液显碱性,故a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+),
故答案为:NaClO、NaClO3;c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+);
(3)次氯酸根离子发生水解,显碱性,ClO-+H2O?OH-+HClO,ClO-浓度越小,水解程度越大,但c(OH-)越小,碱性越弱,
故答案为:次氯酸根离子发生水解,显碱性,ClO-+H2O?OH-+HClO;ClO-浓度越小,OH-浓度越小,碱性减弱
(4)由图可知,ClO3-浓度增大,ClO-浓度减小,结合电子转移守恒,可能是ClO-发生歧化反应:3ClO-$\frac{\underline{\;\;△\;\;}}{\;}$2Cl-+ClO3-,故答案为:3ClO-$\frac{\underline{\;\;△\;\;}}{\;}$2Cl-+ClO3-.
点评 本题考查了含氯化合物的重要应用,为高频考点,侧重于化学与生活的考查,有利于培养学习的积极性,难度不大,注意相关基础知识的积累.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 烧杯中溶液转移到容量瓶中时,未洗涤烧杯 | |
| B. | 移液时,有少量液体溅出 | |
| C. | 定容时,俯视刻度线 | |
| D. | 定容摇匀后发现液面下降,继续加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23g NO2和N2O4的混合气体含有NA个氧原子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量铜粉后,搅拌、可过滤可除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 通过装有NaOH溶液的确洗气瓶来除去CO2中混有的HCl气体 | |
| C. | 某无色未知溶液中加入BaCl2溶液,有白色沉淀,可推断溶液中的一定含有SO42- | |
| D. | 未知溶液中加入盐酸产生使澄清石灰水变浑浊的气体,则溶液中一定大量含CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氧气时,用Na2O2或H2O2作反应物应该选择不同的气体发生装置 | |
| B. | 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀时的离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D和T互为同位素 | B. | C2H6和CH3CH2CH2CH3互为同系物 | ||
| C. | C. 与 与 互为同分异构体 互为同分异构体 | D. | O2和O3互为同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com