
 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A. | 反应开始至2min,Z的反应速率为0.10mol•L-1•min-1 | |
| B. | 该反应的化学方程式为3X+Y?2Z | |
| C. | 2min时,反应达最大限度,但化学反应仍在进行 | |
| D. | 反应达到平衡时,压强是开始时的0.9倍 |
分析 A、根据v=$\frac{△c}{△t}$计算以Z表示的平均反应速率;
B、根据在反应中,反应物物质的量减小,生成物的物质的量增加,变化的物质的量之比等于反应中计量数之比,写出化学方程式;
C、根据图可知该反应为可逆反应,所以达到反应限度时,正逆反应还在进行,不过此时正逆反应速率相等,组成不变,据此判断;
D、利用压强之比等于物质的量之比计算判断.
解答 解:A、由图可知2min内Z的物质的量变化量为0.2mol,所以2min内以Z表示的平均反应速率v(Z)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),故A错误;
B、根据图可知,X的物质的量减小了(1.0-0.7)mol/L=0.3mol/L,Y的物质的量减小了(1.0-0.9)mol/L=0.1mol/L,所以X、Y为反应物,Z的物质的量增加了0.2mol/L,所以Z为生成物,X、Y、Z的物质的量的变化量之比为0.3:0.1:0.2=3:1:2,反应中各物质计量数之比等于物质的浓度的变化量之比,写出化学方程式为3X+Y?2Z,故B正确;
C、根据图可知该反应为可逆反应,所以达到反应限度时,正逆反应还在进行,不过此时正逆反应速率相等,组成不变,故C正确;
D、由图可知开始混合气体的总的物质的量为2mol,平衡时混合气体的物质的量为(0.9+0.7+0.2)mol=1.8mol,压强之比等于物质的量之比,所以反应达平衡此时体系的压强是开始时 $\frac{1.8mol}{2mol}$=0.9倍,故D正确;
故选:A.
点评 本题考查反应速率、方程式书写、化学平衡计算等,难度不大,关键是读懂图象运用所学知识解决问题.


科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}Cl$ | |
| B. | K2O的电子式: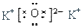 | |
| C. | HCO3-的电离方程式:HCO3-+H2O?CO32-+H3O+ | |
| D. | 比例模型 可以表示CO2分子或SiO2 可以表示CO2分子或SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L CCl4含有的分子数为NA | |
| B. | 2.4gMg溶于足量稀盐酸,转移的电子数为0.1NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
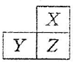 X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X,Y,Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 原子半径:X>Y>Z | |
| B. | 气态氢化物的热稳定性:X<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | X和Z形成的化合物只有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.4gNH3中含有电子数为2NA | |
| B. | 0.1mol/L CuSO4溶液中含有的SO2-4数目为0.1NA | |
| C. | 常温常压下,2.24L O3中含有的氧原子数为0.3NA | |
| D. | 8.7gMnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的氯分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能与NaCl直接发生反应而被氧化为氧化铝 | |
| B. | 长期存放的NaCl与水反应,溶液不再呈中性,可与铝发生反应 | |
| C. | 铝与其中的杂质、NaCl溶液形成原电池,铝被氧化 | |
| D. | 铝与其中的杂质、NaCl溶液形成原电池,铝被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{ρ}{400}$mol•L-1 | B. | $\frac{20}{ρ}$mol•L-1 | C. | $\frac{50ρ}{41}$mol•L-1 | D. | $\frac{25ρ}{41}$mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com