
【题目】向等量的NaOH溶液中分别通入CO2气体。因CO2的通入量不同,得到组分不同的溶液M。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)关系如图,(注:①假设CO2全部逸出;②图中Oa<ab,③图中Oa=ab,④图中Oa>ab)。其中M中只有1种溶质的是( )

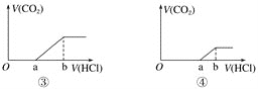
A.只有①B.只有③C.②④D.①③
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何综合利用有毒的NO2气体一直是科研的热门话题,根据反应4NO2+O2=2N2O5,有些科学家设计了如图所示的燃料电池,下列相关说法正确的是

A.图示中Y为NO,可以循环利用
B.电池工作过程中,NO3-向石墨Ⅰ电极迁移
C.正极发生的反应为NO+O2+e- =NO3-
D.转移1 mol电子时,负极产物为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种非金属元素,A、B、C三种金属元素,有如下情况:
(1)X、Y、Z的单质在常温下均为气体
(2)X的单质在Z的单质中燃烧,火焰呈苍白色.产物XZ的水溶液可使石蕊试液变红.
(3)两摩尔X的单质可与一摩尔Y的单质化合生成两摩尔X2Y,X2Y常温下为液体.
(4)Z的单质溶于X2Y中所得溶液具有漂白性.
(5)A的单质可以在Z的单质中燃烧,生成棕红色固体,该固体溶于水呈黄色溶液.
(6)B与Z形成的化合物BZ3溶于水后逐滴滴加NaOH溶液先生成白色沉淀后又逐渐溶解.
(7)C的单质与Y单质反应可能得到两种产物,其中一种为淡黄色固体M.
请完成下列问题:
(1)写出下列物质的化学式:XZ__________,X2Y_________,M_________
(2)Z的单质溶于X2Y中所得溶液中起漂白作用的物质是____________(填化学式)
(3)A的单质与Z的单质反应的化学方程式:________________________________
(4)BZ3与过量的NaOH溶液反应的离子方程式:__________________________
(5)X单质与Z单质的混合气体经点燃充分反应后,冷却至室温,再通入足量的NaOH溶液中,气体被完全吸收,求原混合气体中X单质与Z单质的体积比可能为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在探究废干电池内的黑色固体回收利用时,进行下图所示实验:
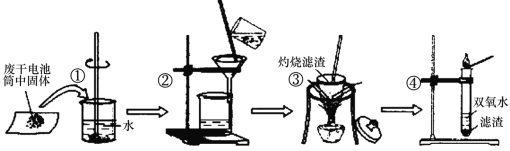
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)锌锰电池的负极材料是________。
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、______、泥三角和三脚架;灼烧滤渣时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有___________。
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为_________, 操作④相关的化学方程式为_______________。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中__________________(填写操作与现象),则证实滤液中含有NH4+。
(5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。
限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液;
限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器请画出实验装置图,标出电极材料、电解质溶液_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是

A. 溶液的pH不再变化
B. 2v正(I-)=v逆(AsO33-)
C. c(AsO43-)/c(AsO33-)不再变化
D. c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月21日是第二十七届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100![]() ,进行了三组实验,其操作和有关图像如下图所示,请回答下列问题:
,进行了三组实验,其操作和有关图像如下图所示,请回答下列问题:

(1)根据上述3组实验可以分析废水中一定不存在的阴离子是_______,一定存在的阳离子是____________________。
(2)写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:_________________________。
(3)分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为__________,所得沉淀的最大质量是__________g。
(4)若通过实验确定原废水中c(Na+)=0.14mol/L,试判断原废水中NO3-是否存在?__________(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)=__________mol/L。(若不存在或不确定则此空不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
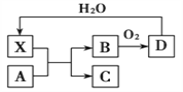
A. X使蔗糖变黑的现象主要体现了X的强氧化性
B. 若A为铁,则足量A与X在室温下即可完全反应
C. 若A为碳单质,则将C通入少量的澄清石灰水,一定可以观察到白色沉淀产生
D. 工业上,B转化为D的反应条件为高温、常压、使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是二十一世纪的“明星金属”,工业制备金属钛是以金红石为原料,发生的反应如下。
反应Ⅰ:aTiO2+bCl2+cC![]() aTiCl4+cCO
aTiCl4+cCO
反应Ⅱ:TiCl4+2Mg ![]() Ti+2MgCl2
Ti+2MgCl2
下列关于反应Ⅰ、Ⅱ的说法中正确的是 ( )
A.反应Ⅰ中TiO2是氧化剂
B.TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂
C.a=b=c=2
D.每生成9.6 g Ti,反应Ⅱ中转移了0.6 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com