
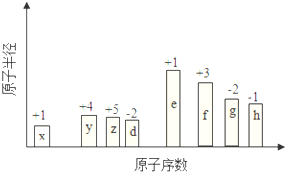
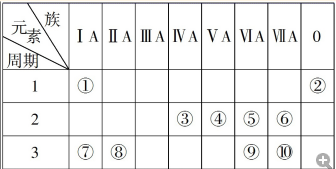
 ��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��
��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��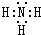 ��λ�ڵ�����������zͬ�����Ԫ�أ�����̬�⻯��Ļ�ѧʽΪAsH3��
��λ�ڵ�����������zͬ�����Ԫ�أ�����̬�⻯��Ļ�ѧʽΪAsH3������ һ����˵�����Ӳ���Խ��ԭ�Ӱ뾶Խ��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С����������Ԫ����˵������������ϼ�=��������O��FԪ�س��⣩����������ϼ�=������-8������ͼ֪��x��y��z��d��e��f��g��h�ֱ���H��C��N��O��Na��Al��S��ClԪ�أ�
��1��y��CԪ�أ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ͬ������������������������ͬ��
��2��h��ClԪ�أ�����������ϼ���+7�ۣ�����������OԪ�ػ��ϼ�Ϊ-2�ۣ����ݷ����и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0ȷ����ѧʽ��
��3��d��g�ֱ���O��SԪ�أ�Ԫ�صķǽ�����Խǿ���⻯����ȶ���Խǿ��
��4��x��z�ֱ���H��NԪ�أ������γɵ�10���ӷ���Ϊ������λ�ڵ�����������zͬ�����Ԫ����AsԪ�أ�As��HԪ���γɵ��⻯��Ͱ�����ѧʽ���ƣ�
��5��e��f ����Ԫ������������Ӧ��ˮ����ֱ���NaOH���������������߷�Ӧ����ƫ�����ƺ�ˮ��
��6��e��d��Na��OԪ�أ���1mol e�ĵ���������d 2��ȼ�գ�������Ϊ�������ƣ�����Naԭ���غ�֪�����ɹ������Ƶ����ʵ���Ϊ0.5mol��ÿ����ѧʽ�к���1�����������ӣ����������к������Ӽ��ͷǼ��Թ��ۼ���
��7��x��d�ֱ���H��OԪ�أ���x��d����Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬��������˫��ˮ��˫��ˮ��ϡ��Һ�ױ����ֽ�����������ˮ�����ö������̺��Ȼ�����������
��� �⣺һ����˵�����Ӳ���Խ��ԭ�Ӱ뾶Խ��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С����������Ԫ����˵������������ϼ�=��������O��FԪ�س��⣩����������ϼ�=������-8������ͼ֪��x��y��z��d��e��f��g��h�ֱ���H��C��N��O��Na��Al��S��ClԪ�أ�
��1��y��CԪ�أ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ͬ������������������������ͬ��Cԭ�Ӻ�����2�����Ӳ㡢������������4������Cλ�ڵڶ����ڵ�IVA�壬
�ʴ�Ϊ��̼������IVA��
��2��h��ClԪ�أ�����������ϼ���+7�ۣ�����������OԪ�ػ��ϼ�Ϊ-2�ۣ����ݷ����и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0ȷ����ѧʽΪCl2O7���ʴ�Ϊ��Cl2O7��
��3��d��g�ֱ���O��SԪ�أ�Ԫ�صķǽ�����Խǿ���⻯����ȶ���Խǿ���ǽ�����O��S������ˮ���ȶ��Դ������⣬ˮ���ӽṹʽΪH-O-H���ʴ�Ϊ��H-O-H��
��4��x��z�ֱ���H��NԪ�أ������γɵ�10���ӷ���Ϊ����������ʽΪ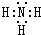 ��λ�ڵ�����������zͬ�����Ԫ����AsԪ�أ�As��HԪ���γɵ��⻯��Ͱ�����ѧʽ���ƣ�����ʽΪAsH3��
��λ�ڵ�����������zͬ�����Ԫ����AsԪ�أ�As��HԪ���γɵ��⻯��Ͱ�����ѧʽ���ƣ�����ʽΪAsH3��
�ʴ�Ϊ��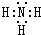 ��AsH3��
��AsH3��
��5��e��f ����Ԫ������������Ӧ��ˮ����ֱ���NaOH���������������߷�Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪOH-+Al��OH��3�TAlO2-+2H2O���ʴ�Ϊ��OH-+Al��OH��3�TAlO2-+2H2O��
��6��e��d��Na��OԪ�أ���1mol e�ĵ���������d 2��ȼ�գ�������Ϊ�������ƣ�����Naԭ���غ�֪�����ɹ������Ƶ����ʵ���Ϊ0.5mol��ÿ����ѧʽ�к���1�����������ӣ��������������ʵ���Ϊ0.5mol������Ϊ0.5NA�����������������Ӻ���������֮��������Ӽ���O-Oԭ��֮����ڷǼ��Լ���
�ʴ�Ϊ��0.5NA��ac��
��7��x��d�ֱ���H��OԪ�أ���x��d����Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬��������˫��ˮ��˫��ˮ��ϡ��Һ�ױ����ֽ�����������ˮ�����ö������̺��Ȼ�������������ѡab��
���� ���⿼��λ�ýṹ�������ϵ��Ӧ�ã����ؿ���ѧ�������жϼ�������������ȷԭ�ӽṹ��Ԫ�����ڱ��ṹ��Ԫ�ػ����������ǽⱾ��ؼ���ע������������������ǡ�O22-������O 2-����Ϊ�״��㣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe+CuSO4�TFeSO4+Cu | B�� | 3CO+Fe2O3 $\frac{\underline{\;����\;}}{\;}$ 2Fe+3CO2 | ||
| C�� | AgNO3+NaCl�TAgCl��+NaNO3 | D�� | 2KMnO4 $\frac{\underline{\;\;��\;\;}}{\;}$ K2MnO4+MnO2+O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ����42.0 L N2����״���� | |
| B�� | ת�Ƶ��ӵ����ʵ���Ϊ1.25 mol | |
| C�� | ��0.250 mol KNO3������ | |
| D�� | ��������Nԭ�ӵ����ʵ���Ϊ3.75 mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

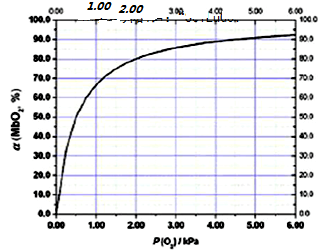
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| Fe2O3 | CO | Fe | CO2 | |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
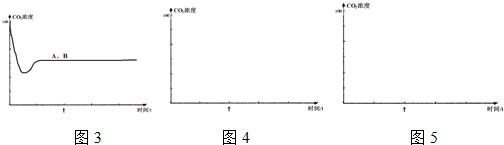
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
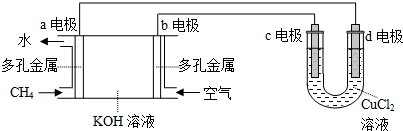
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
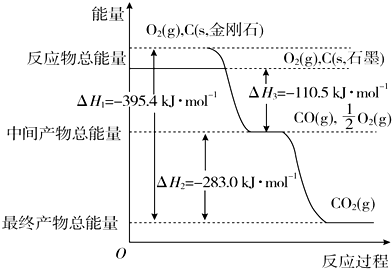
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸ��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��
��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸ��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��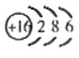 ��
��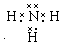 ����
����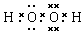 ��
��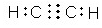 ����
���� NH4++OH-��
NH4++OH-���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com