
【题目】甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,甲中电极为锌片和铜片,乙中电极为石墨棒C1、C2,丙中电极为石墨棒C3、铁片,电极之间用导线相连。则下列叙述正确的是
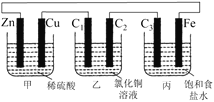
A.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
B.C3是阴极,锌片、C2上都发生氧化反应
C.甲中H+向铜电极移动,丙中Cl-向铁电极移动
D.甲中硫酸溶液的浓度逐渐变小,丙中溶液的pH逐渐减小
【答案】A
【解析】
甲池中Zn、Cu和稀硫酸组成原电池,Zn电极为电源负极,Cu电极为电源正极;乙池和丙池为电解池,C1为乙池阳极,C2为乙池阴极,Fe为丙池阴极,C3为丙池阳极,据此分析。
A.根据分析,C1在乙池中做阳极,氯化铜中Cl-在此电极上失电子生成氯气,C3在丙池中做阳极,氯化钠中Cl-在此电极上失电子生成氯气;铜片在甲池做正极,溶液中的H+得到电子生成氢气,铁片在丙池做阴极,溶液中水电离出的H+在此电极上得到电子也生成氢气,A正确;
B.根据分析,C3为电解池的阳极,Zn电极失去电子发生氧化反应,C2电极得到电子发生还原反应,B错误;
C.甲池中H+向Cu电极移动得电子生成氢气,丙池中Cl-向C3电极移动失电子生成氯气,C错误;
D.甲池中H+得电子生成氢气,Zn失电子生成Zn2+,溶液中硫酸浓度不断减小硫酸锌浓度不断增大;丙池中Cl-失电子生成氯气,H+得电子生成氢气,溶液中剩余NaOH,溶液pH变大,D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】下列对某未知溶液中离子的检验方法及其结论一定正确的是( )
A.加入稀盐酸产生无色气体,一定含有![]()
B.加入氯化钡溶液产生白色沉淀,一定含有![]()
C.加入碳酸钠溶液产生白色沉淀,一定含有Ca2+
D.取溶液进行焰色反应显黄色,一定含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的结构式可用“键线式”简化表示。如CH3一CH=CH一CH3可简写为![]() 。有机物X的键线式为:
。有机物X的键线式为: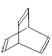 。下列说法不正确的是
。下列说法不正确的是
A.X与苯中碳元素的质量分数相同
B.有机物Y是X的同分异构体,且属于芳香烃,能使溴水褪色,则Y为苯乙烯
C.X能使酸性高锰酸钾溶液褪色
D.X 与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaTiO3、KH2PO4和NaNO2都属于铁电体,它们具有许多特异的性能如当它受压力而改变形状时产生电流,通电时会改变形状等。
(1)基态Ti原子的价电子排布式为___________,属于___________区元素。
(2)KH2PO4晶体中存在的作用力有___________(选填字母)。
A.离子键 B.共价键 C.氢键
(3) NaNO2中N原子的杂化类型为___,键角(填“>、<或=”)____120°,其原因是___________。N、O、Na三种元素的第二电离能(I2)由大到小的顺序为________(用元素符号表示)。
(4)BaTiO3的晶胞如下图所示:

Ti原子的配位数为_____,晶体的密度为ρg/cm3,最近的Ba原子和O原子之间的距离为___(填计算式)nm。( BaTiO3的摩尔质量为233g/mol,NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多有机化合物具有酸碱性。完成下列填空:
(1)a 苯酚 b 苯甲醇 c 苯甲酸 d 碳酸的酸性由强到弱的顺序为______________(填字母);
(2)欲将![]() 转化为
转化为![]() ,则应加入__________。
,则应加入__________。
(3)卤代烃可以与金属镁在无水乙醚作用下生成格氏试剂(RMgX,R为烃基),反应如下:RX+Mg ![]() RMgX,格氏试剂可以跟醛或酮的羰基发生加成反应,烃基加在羰基碳原子上,得到的镁盐水解后生成相应的醇:
RMgX,格氏试剂可以跟醛或酮的羰基发生加成反应,烃基加在羰基碳原子上,得到的镁盐水解后生成相应的醇:
![]()
① 某化合物A的分子式为C10H14O,它由下列合成路线制得:

A的结构简式为________,B的结构简式为________;
② 3-甲基-3-己醇可用该方法以CH3CH2CH2Cl和物质C为原料制得,C的键线式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是
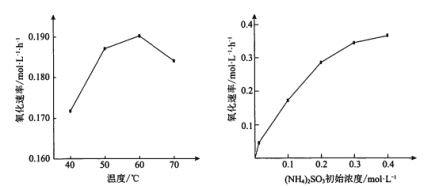
A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。
(1)In在周期表中的位置是___。
(2)In的最高价氧化物的水化物的碱性___Ba(OH)2的碱性(填“>”或“<”)。
(3)![]() In的中子数与电子数的差值为___。
In的中子数与电子数的差值为___。
II.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
C.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(4)C-的电子式:___。
(5)A+、B2-、F3+离子半径由大到小的顺序为___(用离子符号表示)。
(6)电子式表示A2B的形成过程___。
(7)含F3+的溶液中通入过量D,反应的离子方程式是___。
(8)A单质与E反应的离子方程式为___,生成的化合物中化学键的类型是___。
III.硒(34Se)是动物和人体所必需的微量元素之一,也是重要的工业原料,与氧同族。
(9)Se原子结构示意图可表示为___。
(10)下列说法合理的是___。
a.SeO2既有氧化性又有还原性
b.浓硒酸可能具有强氧化性、脱水性
c.热稳定性:H2Se<HCl<H2S
d.酸性:H2SeO4<HBrO4<HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)
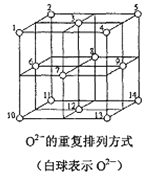
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如图所示:可能用到的有关数据如下:

相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成:在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(1)碎瓷片的作用是___;a的名称是__;
(2)a中发生主要反应的化学方程式为___;本实验最容易产生的有机副产物的结构简式为___。
Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为6.15g。
(3)用碳酸钠溶液洗涤的作用是___,操作X的名称为___。
Ⅲ.产物分析及产率计算:
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有__种不同化学环境的氢原子。②本实验所得环己烯的产率是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com