
 某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:
某学生用0.10mol/L标准NaOH溶液滴定某浓度的盐酸,记录数据数据如下:| 实验序号 | 待测液体积(ML) | 所消耗NaOH标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.50 |
| 2 | 20.00 | 6.00 | 26.00 |
| 3 | 20.00 | 1.40 | 21.4 |
分析 (1)根据酚酞的变色范围确定滴定终点时颜色变化;
(2)先分析数据的有效性,求出消耗标准NaOH溶液的平均体积,然后根据c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$计算;
(3)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以判断滴定误差;
(4)高锰酸钾具有强氧化性,应盛放在酸式滴定管中;依据高锰酸钾溶液氧化亚铁离子为铁离子,本身被还原为锰离子,依据电荷守恒,电子守恒,原子守恒配平书写离子方程式.
解答 解:(1)待测液为酸性,酚酞应为无色,当溶液转为碱性时,溶液颜色变为粉红(或浅红),故答案为:当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不退色;
故答案为:当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内不退色;
(2)三次滴定消耗NaOH标准液的体积分别为:20.00mL、20.00mL、20.00mL,三次数据均有效,平均消耗V(NaOH溶液)=20.00mL,所以c(酸)=$\frac{c(碱)×V(碱)}{V(酸)}$=$\frac{0.10mol/L×20.00mL}{20.00mL}$=0.10 mol/L;
故答案为:0.10 mol/L;
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析,测定结果偏高;
故答案为:偏高;
(4)高锰酸钾具有强氧化性,应盛放在酸式滴定管甲中;高锰酸钾溶液氧化亚铁离子为铁离子,本身被还原为锰离子,依据电荷守恒,电子守恒,原子守恒配平书写离子方程式为:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
故答案为:甲;MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
点评 本题主要考查了滴定原理、仪器的使用、指示剂的选择、误差分析等,理解滴定滴定原理是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铝溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 稀硫酸中滴加氢氧化钡溶液:H++OH-═H2O | |
| C. | 碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 540 mL | B. | 336 mL | C. | 224 mL | D. | 168 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
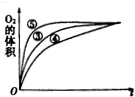 某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分 组 实 验 | 催化剂 | |
| ① | 10mL 5%的H2O2溶液 | 无 |
| ② | 10mL 2%的H2O2溶液 | 无 |
| ③ | 10mL 5%的H2O2溶液 | 1mL 0.1mol/L的FeCl3溶液 |
| ④ | 10mL 5%的H2O2溶液+少量盐酸 | 1mL 0.1mol/L的FeCl3溶液 |
| ⑤ | 10mL 5%的H2O2溶液+少量NaOH溶液 | 1mL 0.1mol/L的FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
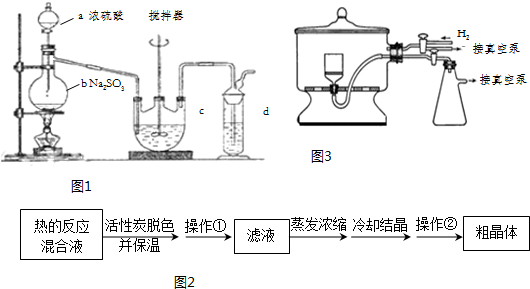
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
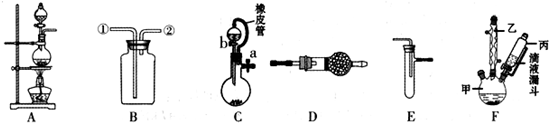
 ),有关反应、数据和实验步骤如下:
),有关反应、数据和实验步骤如下:
| 熔点/℃ | 沸点/℃ | 颜色 | 水溶性 | 相对分子质量 | |
| 对氯甲苯 | 7.5 | 162 | 无色 | 难溶 | 126.5 |
| 对氯苯甲酸 | 243 | 275 | 白色 | 微溶 | 156.5 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水不导电,所以水不是电解质 | |
| B. | SO3水溶液的导电性很强,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com