
【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 ______ ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 ______ .
(2)操作Ⅱ中红色褪去的可能原因是 ______ .
(3)用反应![]() 测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______
测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______ ![]() 填化学式
填化学式![]() 酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______
酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______ ![]() 填酸或碱
填酸或碱![]() 式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为______ .
(5)向FeSO4溶液中加入一定量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 ______ .
【答案】![]()
![]() 溶液a中过量H2O2与酚酞发生反应 H2SO4 酸 滴至最后一滴时溶液由紫色变为无色,且半分钟内不变色 0.0025
溶液a中过量H2O2与酚酞发生反应 H2SO4 酸 滴至最后一滴时溶液由紫色变为无色,且半分钟内不变色 0.0025 ![]()
![]()
【解析】
(1)Na2O2为离子化合物,据此书写电子式;根据实验证实了溶液a中H2O2的存在,则Na218O2与H2O反应先生成氢氧化钠和H2O2,H2O2再分解生成水和氧气;
(2)根据H2O2具有强氧化性即漂白性进行分析;
(3)根据KMnO4溶液能氧化HCl,所以用稀H2SO4酸化,KMnO4溶液具有强氧化性,应装在酸式滴定管中,终点确定的方法是滴至最后一滴时溶液由紫色变为无色,且半分钟内不变色,根据KMnO4与H2O2反应的物质的量之比求得H2O2的物质的量,进而求得溶液a中c(H2O2);
(4)向溶液a中滴加FeSO4溶液,Na2O2氧化FeSO4溶液生成Fe(OH)3沉淀和氧气;
(5)向FeSO4溶液中加入一定量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,所以Na2O2固体仅作氧化剂,FeSO4溶液被氧化成Fe(OH)3沉淀,据此书写;
(1)Na2O2为离子化合物,电子式为![]() ;实验证实了溶液a中H2O2的存在,则Na218O2与H2O反应先生成氢氧化钠和H2O2,H2O2再分解生成水和氧气,所以Na218O2与H2O反应的总化学方程式为
;实验证实了溶液a中H2O2的存在,则Na218O2与H2O反应先生成氢氧化钠和H2O2,H2O2再分解生成水和氧气,所以Na218O2与H2O反应的总化学方程式为![]() ;
;
(2)因为H2O2具有强氧化性即漂白性,所以操作Ⅱ中红色褪去的可能原因是溶液a中过量H2O2与酚酞发生反应;
(3)根据KMnO4溶液能氧化HCl,所以用稀H2SO4酸化,KMnO4溶液具有强氧化性,应装在酸式滴定管中,终点确定的方法是滴至最后一滴时溶液由紫色变为无色,且半分钟内不变色,根据KMnO4与H2O2反应的离子方程式可知关系式为:
2MnO4- ~ 5H2O2
2mol 5mol
0.002 molL-1×0.01L n(H2O2) 则n(H2O2)=5×10-5 mol
所以n(H2O2)=![]() =0.0025 molL-1;
=0.0025 molL-1;
(4)向溶液a中滴加FeSO4溶液,Na2O2氧化FeSO4溶液生成Fe(OH)3沉淀和氧气,离子方程式为:![]() ;
;
(5)向FeSO4溶液中加入一定量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,所以Na2O2固体仅作氧化剂,FeSO4溶液被氧化成Fe(OH)3沉淀,离子方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下,醋酸溶液中存在电离平衡CH3COOH![]() CH3COO-+H+
CH3COO-+H+
(1)某温度时,0.1mol·L-1的醋酸溶液中的c(H+)与0.01mol·L-1的醋酸溶液中的c(H+)的比值___(填“大于”“小于”或“等于”)10;
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是:___;
A.c(H+) B.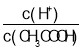 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
(3)现有pH均为3的醋酸、硫酸两瓶溶液:
①设两种溶液的物质的量浓度依次为c1、c2,则其关系式为:c1___c2(用“<”“>”或“=”表示,下同);
②取相同体积的两种酸分别加入等体积的蒸馏水后,再分别加入少量等量的锌粉,反应开始时放出氢气的速率依次为v1、v2,则其关系式为v1___v2;反应结束放出的氢气的体积依次为V1、V2,则其关系式为V1___V2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是
A.锗不能与强碱溶液反应
B.氢氧化锗具有两性
C.氧化锗易溶于水
D.氧化锗的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素A、B、C、D、E,原子序数依次增大,A和B是组成物质种类最多的元素,C是地壳中含量最多的元素,D与B同族,E的3d轨道中有9个电子。
(1)C、D两种元素形成的化合物统称硅石,可通过__方法区分其结晶形和无定形的两种存在形态,C的电子排布图为___。
(2)M和N是生活中两种常见的有机物,M能与CaCO3反应,可用于厨房除水垢;N分子中的碳原子数目与M中相同,二者互为同分异构体,可发生银镜反应。M中存在化学键的类型是__;
A.离子键 B.极性键 C.非极性键 D.σ键 E.π键
N分子官能团中碳原子的轨道杂化类型是__。
(3)第一电离能:B___D(用“>”或“<”表示,下同);熔点:DC2晶体___D晶体。
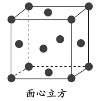
(4)E单质为面心立方晶体,其原子半径为Rcm,其晶胞棱长为anm,则E单质的密度为___g·cm-3(用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包暗红色粉末样品可能是MgCO3、Fe2O3和FeO的混合物。经测定后,结论是不存在FeO。
I.某学生想自己设计实验方案,以证明样品中确实没有FeO。除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述实验操作的步骤、实验现象和结论:__________________________________________________。
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测定上述样品中Fe2O3的质量分数,某同学准备用如图所示各仪器 按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数。
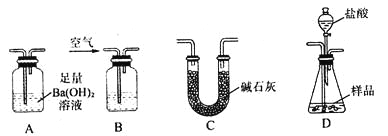
请回答下列问题:
(1)盛装盐酸的仪器的名称是___________,装置的连接顺序是___________→____________→____________→____________(填图中序号字母,各仪器只能选用一次)。
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是________________________________________________。
(3)为提高测定的准确度,在B中最应加入的物质是下列各项中的_____________(填序号)。
a.饱和NaHCO3溶液 b.蒸馏水
c.浓硫酸 d.NaOH溶液
(4)在进行实验方案评价时,有同学认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求。实验证明,若用此法测得Fe2O3的质量分数将__________(填“偏大”“偏小”或“不变”之一)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列有机物的系统命名或结构简式。
(1)![]() ___;
___;
(2)![]() ___;
___;
(3)CH3CH(CH3)C(CH3)2(CH2)2CH3___;
(4)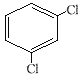 ___;
___;
(5)2,5-二甲基-4-乙基庚烷__;
(6)2-甲基-2-戊烯____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是
A.标准状况下,11.2 L CO2中含C=O键的数目为6.02×1023
B.反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O
C.理论上吸收HCHO与消耗Fe3+的物质的量之比为4:1
D.30 g HCHO被氧化时转移电子数目为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法错误的是( )
Y | |||
M | X | Z |
A.钠与Z可能形成Na2Z2化合物
B.由X与氧组成的物质在熔融时能导电
C.Y的最简单气态氢化物的热稳定性比X的强
D.M的简单离子半径是同周期中简单离子半径最小的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com