
【题目】Ⅰ、已知下面在298K时的热化学方程式:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,CH4(g)+2O2(g)=CO2(g)+2H2O (l) ΔH=-890.3 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1。根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是___。
(2)根据以上反应,则C(s)+2H2(g)=CH4(g)的焓变ΔH=___。
(3)已知H2O(l)=H2O(g) ΔH=+44.0kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:___。
Ⅱ、为了解金属腐蚀的原因和寻求防止金属腐蚀的方法具有重要意义。
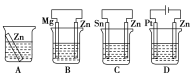
(1)分别放在以下装置(都盛有0.1mol·L-1的H2SO4溶液)中的四块相同的纯锌片,其中腐蚀最快的是___。
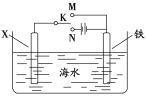
(2)利用如图装置,可以模拟铁的电化学防护。其中X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为___。
【答案】H2 -74.8kJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1 C N 牺牲阳极保护法(或牺牲阳极的阴极保护法)
【解析】
根据热化学方程式的含义以及对应的反应热进行计算;
(2)根据盖斯定律来计算化学反应的焓变;
(3)根据盖斯定律来解答。
(1)设质量都为m,根据热化学方程式可知相同质量的H2、CH4、C完全燃烧时,放出热量分别是![]() 、
、![]() 、
、![]() 、最大值应为
、最大值应为![]() ,因此相同质量的H2、CH4、C完全燃烧时,放出热量最多的是H2;
,因此相同质量的H2、CH4、C完全燃烧时,放出热量最多的是H2;
(2)已知:
①2H2(g)+O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH= -393.5 kJ·mol-1
根据盖斯定律可知①+③-②得热化学方程式为
C(s)+2H2(g)=CH4(g)△H=-74.8 kJ·mol-1;
(3)已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890.3 kJ·mol-1
②H2O(l)=H2O(g) ΔH= +44.0 kJ·mol-1
根据盖斯定律可知①+②×2即得到热化学方程式CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -802.3 kJ·mol-1;
Ⅱ(1)金属腐蚀快慢顺序是:电解池阳极>原电池负极>化学腐蚀>原电池正极>电解池阴极,根据图知,B中锌作正极、C中锌作负极、D中锌作阴极,所以锌被腐蚀快慢顺序是:C > A > B > D,则被腐蚀最快的是C,故C正确;
(2)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法。


科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
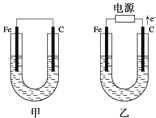
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的___棒,乙池中的___棒。
②乙池中阳极的电极反应式是___。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式___。
②甲池中碳极上电极反应式是___,乙池碳极上电极反应属于___(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为___。
④若乙池转移0.02mole﹣后停止实验,池中电解质溶液体积是200mL,则溶液混合均匀后的pH=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)鉴别KCl溶液和K2CO3的试剂是___________,离子方程式为________________。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是________,离子方程式为___________。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用________方法,化学方程式为_____________。
(4)除去铁粉中混有铝粉的试剂是___________,离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于隐形眼镜材料的聚合物片段如下:

下列关于该高分子说法正确的是
A. 结构简式为:
B. 氢键对该高分子的性能没有影响
C. 完全水解得到的高分子有机物,含有官能团羧基和碳碳双键
D. 完全水解得到的小分子有机物,具有4种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“双线桥”标出电子转移的方向和数目,并分别指出 氧化剂和氧化产物。
(1)Fe+CuSO4=FeSO4+Cu ________ 氧化剂是 ____________氧化产物是_____________,
(2)3CO+Fe2O3![]() 3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置闭合电键K时,电流计A的指针将发生偏转。试回答:
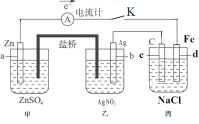
(1)乙中Ag电极的电极反应是___,若电路中有0.02mol电子通过,则甲中a电极溶解的质量为___g;
(2)闭合电键K一段时间后,丙池中发生的总的化学方程式是___;
(3)丙池中反应进行较长时间后,收集到标准状况下氢气2.24L此时测得丙池溶液质量实际减少3.75g,含有碱0.100mol(不考虑气体在水中的溶解),则实际放出气体的物质的量是___mol。
(4)如果要给丙中铁片上镀上一层Cu,则丙池应作何改进___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
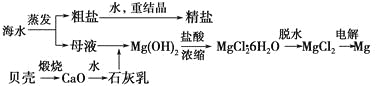
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2O(g)===2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1 ②H2S(g)===H2(g)+S(g) ΔH=+20.1 kJ·mol-1下列判断正确的是( )
A. 氢气的燃烧热:ΔH=-241.8 kJ·mol-1
B. 相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ
C. 由①②知,水的热稳定性小于硫化氢
D. ②中若生成固态硫,ΔH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com