
【题目】下列除杂方式正确的是
A. CO2气体中含有的少量杂质SO2可通过饱和Na2CO3溶液除去
B. NaOH溶液中含有少量的Ba(OH)2可加入适量的Na2SO4过滤除去
C. K2CO3固体中含有少量的NaHCO3杂质可用加热的方式提纯
D. Cu粉中含有的少量杂质Fe可加入FeCl3溶液除去
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有下列八种有机物:①乙烯、②、苯 ③、甲苯④、溴乙烷 ⑤苯酚、⑥乙醇、⑦乙二醇。请回答:
(1)⑤跟氯化铁溶液反应的现象是______________________。
(2)一定条件下能发生消去反应的是____________。(填序号,下同)。
(3)如何检验④的溴原子__________________________________________;
写出④发生反应的化学方程式________________________________________。
(4)乙醇分子中不同的化学键如下图所示,关于乙醇在下列反应中断裂的化学键的说法不正确的是___________(填字母)。
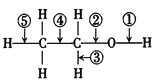
A.和金属钠反应时①键断裂
B.和浓H2SO4共热至170℃时②⑤键断裂
C.在Ag或Cu催化下和O2 反应①③键断裂
D.在Ag或Cu催化下和O2 反应①⑤键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:苯酚(![]() )在水中的电离方程式为
)在水中的电离方程式为![]() ,25℃时,苯酚的电离常数Ka=1.0×10-10。25℃时,用0.0100molL-1的NaOH溶液滴定20.00mL0.0100molL-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示。下列说法正确的是
,25℃时,苯酚的电离常数Ka=1.0×10-10。25℃时,用0.0100molL-1的NaOH溶液滴定20.00mL0.0100molL-1的苯酚溶液,溶液的pH与所加NaOH溶液的体积(V)的关系如图所示。下列说法正确的是
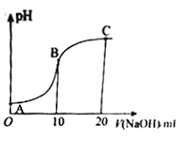
A. A点溶液中,苯酚的电离度约为0.01%
B. B点溶液的pH<7
C. C点溶液中存在c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D. A 点溶液加少量水稀释,溶液中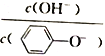 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、镁、镍在工业生产和科研领域有广泛用途。请回答下列问题:
(1)基态碳原子中,能量最高的电子所占用的能级符号为_________;该能级中原子轨道的电子云形状为______________________。
(2)从石墨中可剥离出由单层碳原子构成的石墨烯,石墨烯中碳原子和共价键的数目之比为________。
(3)Mg2+能形成多种配合物和配离子,如Na4[Mg(PO3)4]、Mg[EDTA]2- EDTA的结构简式为(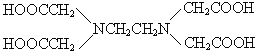 )等。
)等。
①PO3-的立体构型为____________,其中心原子的杂化轨道类型为__________,其中杂化轨道的作用为__________________________。
②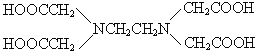 是常用的分析试剂。其中位于同周期的三种基态原子第一电离能由小到大的顺序为________________(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为_____________。
是常用的分析试剂。其中位于同周期的三种基态原子第一电离能由小到大的顺序为________________(用元素符号表示);这三种元素形成的一种离子与CS2互为等电子体,该离子符号为_____________。
(4)晶体镁的堆积模型为____________;其中镁原子的配位数为______________。
(5)碳、镁、镍形成的某晶体的晶胞结构如图所示。若晶体密度为ρg·cm-1,阿伏伽德罗常数的值为NA,则晶胞参数a=___________pm(用代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时:c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关。下列说法错误的是
A. 臭氧、醋酸、双氧水都能杀菌消毒
B. 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应
C. “以火烧之,紫青烟起,乃真硝石(KNO3)",“紫青烟”是因为发生了焰色反应
D. 有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(M分)研究碳、氮及其化合物的转化对于环境的改善有重大意义。氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)==NO2(g)+O2(g) △H=-200.9kJ·mol-1
2NO(g)+O2(g)==2NO2(g) △H=-2116.2kJ·mol-1
(1)则反应I的热化学方程式为_________________。
(2)有人设想将CO按下列反应除去:2CO(g)==2C(s)+O2(g) △H >0,你认为该设想能否实现并说明理由:_____________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。己知常温时,甲酸的电离平衡常数Ka= l.70×10-4。向20 mL 0.1 mol/L的甲酸钠溶液中滴加10mL 0.1 mol/L的盐酸,混合液呈_____(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_____________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.1000 mol NO和2.030 mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如下表:
固体活性炭/mol | NO/mol | A/mol | B/mol | |
200℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为_________(填“吸热”或“放热”)反应。
②200℃时,平衡后向恒容容器中再充入0.100 0 mol NO,再次平衡后,NO的百分含量将__________(填“增大”“减小”或“不变”)。
③计算反应体系在335℃时的平衡常数_______________。
(5)CO2的处理方法有多种,将少量CO2气体通入石灰乳中充分反应,达到平衡后,测得溶液中c(OH-)=c mol/L,则c(CO32-)=_____ mol·L-1(用含a、b、c的代数式表示)。(已知Kap(CaCO3)=a,Kap[Ca(OH)2]=b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表中短周期的一部分,下列说法正确的是()

A. 非金属性:Y>Z>M
B. 离子半径:M->Z2->Y-
C. ZM2分子中各原子的最外层均满足8电子稳定结构
D. 三种元素中,Y的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com