
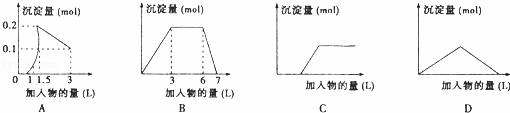
下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是( )
|
| A. | 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液中加入0.1 mol/L稀H2SO4溶液 |
|
| B. | 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的1L混合液中加入0.1mol/L NaOH溶液 |
|
| C. | 向烧碱溶液中滴加明矾溶液 |
|
| D. | 向Ca(OH)2溶液中逐渐通入二氧化碳 |
| 镁、铝的重要化合物.. | |
| 专题: | 图示题. |
| 分析: | A、Ba(OH)2、NaAlO2混合液中加入稀H2SO4溶液,酸碱中和反应先发生,且生成硫酸钡沉淀,然后是硫酸和NaAlO2发生反应的过程; B、AlCl3和 NH4Cl的1L混合液中加入NaOH溶液,先出现白色沉淀氢氧化铝,然后是铵根离子和氢氧根离子之间反应生成一水合氨,最后是氢氧化铝溶解的过程; C、向氢氧化钠中加明矾,开始阶段碱过量,不会出现沉淀,然后是铝离子和偏铝酸盐生成氢氧化铝沉淀的过程; D、Ca(OH)2溶液中逐渐通入二氧化碳,开始会出现白色沉淀,然后沉淀逐渐消失. |
| 解答: | 解:A、Ba(OH)2、NaAlO2混合液中加入稀H2SO4溶液,酸碱中和反应先发生,且生成硫酸钡沉淀,所以反应开始就有沉淀生成,然后是硫酸和NaAlO2发生反应的过程,当加入2.5L硫酸,沉淀氢氧化铝全部溶解,故A错误; B、AlCl3和 NH4Cl的1L混合液中加入NaOH溶液,先出现白色沉淀氢氧化铝,然后是铵根离子和氢氧根离子之间反应生成一水合氨,最后是氢氧化铝溶解的过程,消耗NaOH的量之比是3:3:1,故B正确; C、向氢氧化钠中加明矾,开始阶段碱过量,不会出现沉淀,然后是铝离子和偏铝酸盐生成氢氧化铝沉淀的过程,故C正确; D、Ca(OH)2溶液中逐渐通入二氧化碳,开始会出现白色沉淀,然后沉淀逐渐消失,两个过程消耗的二氧化碳的量相等,故D正确. 故选A. |
| 点评: | 本题考查学生物质的性质以及化学反应发生的先后知识,结合图象来考查,增加了题目的难度. |


科目:高中化学 来源: 题型:
下列说法下列正确的是
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为部分短周期元素化合价及其相应原子半径的数据.请回答下列问题:
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
| 最高化合价 | +6 | +4 | +5 | +5 | +4 | +7 | ||
| 最低化合价 | ﹣2 | ﹣4 | ﹣2 | ﹣3 | ﹣1 | ﹣3 | ﹣4 | ﹣1 |
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 .
(2)A、B、C、E的简单氢化物稳定性顺序是 (用化学式回答).
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是 .
(4)请写出B的单质的一种重要用途: ;工业上制取该单质的原理反应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)+Q;Q>0,下列研究目的和示意图相符的是 ( )
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列正确的叙述有( )
①CO2、NO2、P2O5均为酸性氧化物
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2的反应、Ba(OH)2•8H2O与NH4Cl的反应均既为氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电化学腐蚀
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是:能透过滤纸,加热蒸干、灼烧后都有氧化铝生成
⑦苛性钾、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
⑧金属元素和非金属元素形成的化合物一定是离子化合物.
|
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或结论表述正确的是( )
|
| A. | 纸层析实验中若选择水做固定相,有机溶剂做流动相,则亲水性强的成分在流动相中分配的少一些,在毛细现象作用下,随流动相移动的速度快一些 |
|
| B. | 判断CuO和MnO2对H2O2分解的催化效率,可通过比较H2O2溶液析出气泡的快慢程度,或测定单位时间内产生氧气的体积 |
|
| C. | 食醋总酸含量测定实验中,实验结束时碱式滴定管尖嘴部位有气泡,则测定的醋酸含量偏高 |
|
| D. | 将硫酸亚铁和硫酸铵的混合溶液加热浓缩,冷却结晶后可析出摩尔盐粗产品,再用酒精洗去晶体表面的水分,加热烘干后称重,计算产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2•yCuCO3.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L﹣1的Cu(NO3)2溶液、2.0mL 0.50mol•L﹣1的NaOH溶液和0.25mol•L﹣1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
表Ⅰ表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是 n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃ .
②80℃时,所制得的孔雀石有少量褐色物质的原因是 Cu(OH)2受热分解为CuO .
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
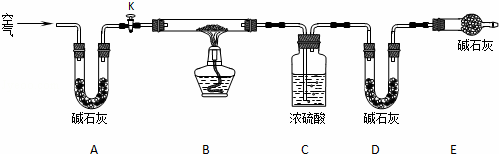
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4: 继续通一段时间空气至装置冷却 .
步骤5:称量相关装置的质量.
①装置A的作用是 除去空气中的CO2和H2O ;若无装置E,则实验测定的x/y的值将 偏小 (选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 BC、BD、CD (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 5Cu(OH)2•2CuCO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
关于电解质的下列说法中正确的是( )
A.在水溶液中和熔融状态下能导电的化合物
B.在水溶液中或熔融状态下能导电的物质
C.在水溶液中或熔融状态下能导电的化合物
D.HCl是电解质,所以液体HCl可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+下列说法正确的是
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com