
| A. | 0.6 mol•L-1 | B. | 0.8 mol•L-1 | C. | 1.0 mol•L-1 | D. | 1.2 mol•L-1 |
分析 还原性强弱:I->Fe2+,氯气先氧化碘离子,再氧化亚铁离子;碘离子完全氧化后,溶液中有一半的Fe2+被氧化成Fe3+,发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+;设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c、c(Fe2+)=cmol/L,所以与碘离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$n(I-)=$\frac{1}{2}$×2c•V=0.1c mol;反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,最后结合消耗氯气的总物质的量列式计算即可.
解答 解:还原性强弱:I->Fe2+,往100mL碘化亚铁溶液中缓慢通入4.48L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,
碘离子完全氧化后,溶液中有一半的Fe2+被氧化成Fe3+,发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+,
设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c、c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为:n(Cl2)=$\frac{1}{2}$n(I-)=$\frac{1}{2}$×2c•V=0.1c mol,
反应完成后溶液中有一半的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,
则:0.025cmol+0.1cmol=0.1mol,
解得c=0.8mol/L,
故选B.
点评 本题考查氧化还原反应的有关计算,为高频考点,题目难度中等,侧重于学生的分析能力和计算能力来的考查,明确溶液中离子反应的先后顺序为解答关键.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯原子的原子结构示意图: | B. | NH4Cl的电子式: | ||
| C. | HCl分子中的化学键为极性共价键 | D. | 聚乙烯的结构简式:CH2═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | |
| B. | 钢铁制品和铜制品均既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ③④ | C. | ①③ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铱为非金属元素 | |
| B. | ${\;}_{77}^{192}$Ir中子数与质子数的差为38 | |
| C. | 铱元素与碘元素位于同一周期 | |
| D. | ${\;}_{77}^{192}$Ir核外含有115个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
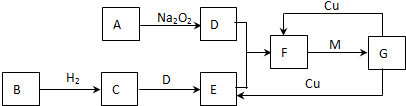
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定量(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH${\;}_{4}^{+}$)>2c(SO${\;}_{4}^{2-}$) | |
| B. | 向25mL0.1mol/L的溶液①氨水 ②NH4Cl溶液分别加入25mL0.1mol/L盐酸后,溶液中c(NH${\;}_{4}^{+}$):①>② | |
| C. | 将0.2mol/L CH3COOH溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:2c(OH-)+c(CH3COO-)=2c(H+)+c(CH3COOH) | |
| D. | 0.1mol/L的KHA溶液,其pH=10:c(K+)>c(A2-)>c(HA-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑦⑧ | B. | ⑤⑥⑧ | C. | ①④⑤⑥ | D. | ③⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
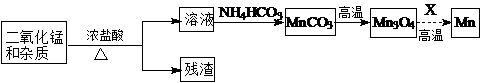
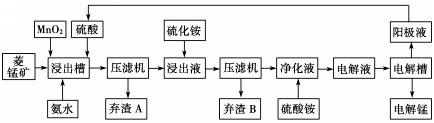
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.5 | 9.8 | 3.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com