
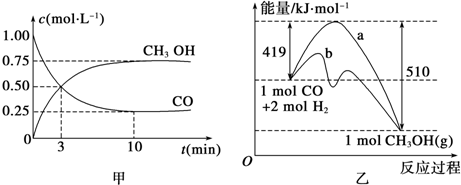
���� ��1������v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�
��2�����ݷ�Ӧ��������������������������Ȼ��Ƿ��ȣ�����д�Ȼ�ѧ��Ӧ����ʽ������ֻ�ܸı䷴Ӧ��;�������ܸı䷴Ӧ�ķ�Ӧ�ȣ�
��3����ѧƽ�ⳣ��Ϊ������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ������¶ȶԻ�ѧƽ���Ӱ��������ƽ�ⳣ���ı仯��
��4��ʹ $\frac{n��C{H}_{3}OH��}{n��CO��}$����ѧƽ��Ӧ�����ƶ���
��� �⣺��1����ͼ��֪��COŨ�ȱ仯��Ϊ1.00mol/L-0.25mol/L=0.75mol/L����t=10min����v��CO��=$\frac{0.75mol}{10min}$=0.075mol/��L•min����
�ʴ�Ϊ��0.075mol/��L•min����
��2����Ӧ���������Ϊ419kJ���������������Ϊ510kJ����÷�ӦΪ���ȷ�Ӧ���ʱ��H��0���ų�������Ϊ419kJ-510kJ=91kJ���Ȼ�ѧ����ʽΪCO��g��+2H2��g��=CH3OH��g����H=-91 kJ/mol��
�÷�Ӧʹ�ô�����ֻ�ܸı䷴Ӧ��;�����ͷ�Ӧ����Ļ�ܣ������ܸı䷴Ӧ�ȣ�
�ʴ�Ϊ����H��0��CO��g��+2H2��g��=CH3OH��g����H=-91 kJ/mol�����ܣ�
��3���ɷ�ӦCO��g��+2H2��g��?CH3OH��g������K=$\frac{c��C{H}_{3}OH��}{c��CO��•{c}^{2}��{H}_{2}��}$����÷�ӦΪ���ȷ�Ӧ���������¶ȣ���ѧƽ�������ƶ���Kֵ��С��
�ʴ�Ϊ��$\frac{c��C{H}_{3}OH��}{c��CO��•{c}^{2}��{H}_{2}��}$����С��
��4��ʹ $\frac{n��C{H}_{3}OH��}{n��CO��}$����ѧƽ��Ӧ�����ƶ����������¶�ʱ��ѧƽ�������ƶ������������³���He����ѧƽ�ⲻ�ƶ���ʹ�ô�����ѧƽ�ⲻ�ƶ����ں����������ٳ���1molCO��2molH2��ѹǿ����ѧƽ�������ƶ����������⣬��c��ȷ��
�ʴ�Ϊ��c��
���� ���⿼���Ϊ�ۺϣ��漰Ӱ�컯ѧƽ������ء��Ȼ�ѧ��Ӧ����ѧƽ�ⳣ������Ӧ���ʵļ����֪ʶ�㣬��Ŀ�Ѷ��еȣ�����ע�ضԸ߿��ȵ�֪ʶ�Ŀ��飬���������ѧ���ķ�����������������ѧ����������


 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 6�� | B�� | 7�� | C�� | 8�� | D�� | 9�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
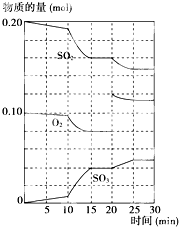 ��һ�������£���������������������·�Ӧ��2SO2��g��+O2��g��?2SO3��g������H��0��
��һ�������£���������������������·�Ӧ��2SO2��g��+O2��g��?2SO3��g������H��0���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
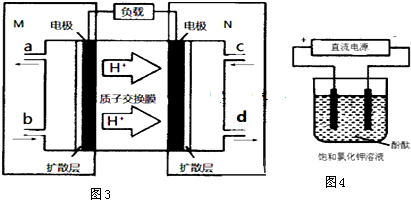
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ����̿/mol | NO/mol | A/mol | B/mol | ��/Mpa | |
| 200�� | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335�� | 2.005 | 0.0500 | 0.0250 | 0.0250 | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
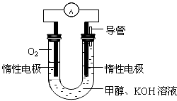 �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
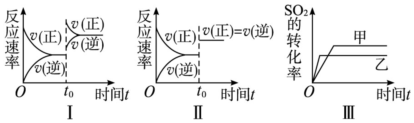
| A�� | ͼ���о�����t0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ�� | |
| B�� | ͼ���о������¶ȶԻ�ѧƽ���Ӱ�죬���ҵ��¶Ƚϵ� | |
| C�� | ͼ���о����Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ� | |
| D�� | ͼ���о�����t0ʱ�̼��������Է�Ӧ���ʵ�Ӱ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ | |
| B�� | ��H��0��ʾ��������������ڷ�Ӧ��������� | |
| C�� | ��H �ĵ�λkJ•mol-1������Q�ĵ�λΪkJ | |
| D�� | ��ѧ�����ѹ������ͷ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ۢ� | C�� | �٢� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com