
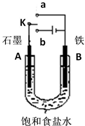
| A. | 若开始时开关K与a连接,其反应与铁的吸氧腐蚀类似 | |
| B. | 若开始时开关K与b连接,其原理类似于钢铁防护中外加电流的阴极保护法 | |
| C. | 若开始时开关K与b连接,则标准状况下B极产生2.24 L气体,转移电子0.2 mol | |
| D. | 若开始时开关K与b连接,则反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同) |
分析 A、若开始时开关K与a连接,构成原电池,其中的饱和食盐水呈中性,发生吸氧腐蚀;
B、金属的电化学防护措施有原电池原理的牺牲阳极的阴极保护法和电解池的外加电流的阴极保护法;
C、若开始时开关K与b连接,是电解池,B极的电极反应式为:2H++2e-=H2↑,则标准状况下B极产生2.24 L气体物质的量为0.1mol,所以转移电子0.2 mol;
D、电解饱和食盐水产生氢气和氯气,要恢复原状态,只要通入氯化氢气体即可.
解答 解:A、若开始时开关K与a连接,构成原电池,其中的饱和食盐水呈中性,所以是钢铁的吸氧腐蚀,故A正确;
B、金属的电化学防护措施有原电池原理的牺牲阳极的阴极保护法和电解池的外加电流的阴极保护法,所以开关K与b连接,故B正确;
C、若开始时开关K与b连接,是电解池,B极的电极反应式为:2H++2e-=H2↑,则标准状况下B极产生2.24 L气体物质的量为0.1mol,所以转移电子0.2 mol,故C正确;
D、电解饱和食盐水产生氢气和氯气,要恢复原状态,只要通入氯化氢气体即可,如果加盐酸恢复原状态,则发生了深度电解,也就是溶剂水放电了,故D错误;
故选D.
点评 本题考查知识点较多,明确吸氧腐蚀、电化学保护、电极反应式的书写和相关计算,题目难度不大,平时注意知识的积累.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
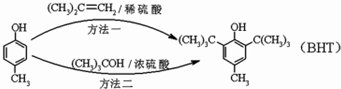 BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,下面是两种合成BHT的方法:下列说法正确的是( )
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,下面是两种合成BHT的方法:下列说法正确的是( )| A. | 方法一和方法二的反应类型分别是取代和加成反应 | |
| B. |  与BHT互为同系物 与BHT互为同系物 | |
| C. |  能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 | |
| D. | 1molBHT可与含有2molBr2的浓溴水发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 过渡元素中可寻找制备催化剂及耐高温、耐腐蚀材料的元素 | |
| C. | 在非金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 周期表中第Ⅷ族元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
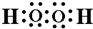 含有的化学键类型有BC(填序号).
含有的化学键类型有BC(填序号). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 | |
| C. | pH计也可用于酸碱中和滴定终点的判断 | |
| D. | 海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量AlO2-的溶液中:K+、NH4+、Br-、HSO3-可以大量共存 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ•mol-1 | |
| C. | 将少量SO2通入NaClO溶液中:2ClO-+SO2+H2O═SO32-+2HClO | |
| D. | 在某钠盐溶液中含等物质的量的Cl-、I-、SO32-、CO32-、NO3-、SiO32-中一种或多种,当加入过量的盐酸产生气泡,溶液颜色变深但未见沉淀生成,则原溶液中一定有NO3-、I-和CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2+4HF=SiF4↑+2H2O;用氢氟酸蚀刻玻璃 | |
| B. | 4Na+TiCl4 $\frac{\underline{\;高温\;}}{\;}$4NaCl+Ti;用金属钠与熔融TiCl4反应制取金属Ti | |
| C. | CO32-+H2O?H2CO3+OH-;用热的纯碱溶液清洗餐具油污 | |
| D. | MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;工业上用电解熔融氯化镁制取金属镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84 g NaHCO3晶体中含有NA个CO32- | |
| B. | 室温下,14.0 g乙烯和丁烯的混合气体中含有C-H键数目为2.0NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| D. | 78 g Na2O2与足量的CO2反应,电子转移个数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com