
| A. | ①④ | B. | ①② | C. | ①③ | D. | ③④ |
分析 同一周期元素,元素的非金属性随着原子序数增大而增强、元素的金属性随着原子序数增大而减弱,
①E的原子序数最大,所以有可能是第ⅦA元素,则D就有可能是第ⅥA;
②元素的金属性越强,其最高价氧化物的水化物碱性越强;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,其单质的氧化性越强.
解答 解:同一周期元素,元素的非金属性随着原子序数增大而增强、元素的金属性随着原子序数增大而减弱,
①E的原子序数最大,所以有可能是第ⅦA元素,则D就有可能是第ⅥA,所以E元素的最高化合价为+7时,D元素的负化合价可为-2,故①正确;
②A、B为短周期元素,A的金属性大于B,如果A(OH)n为强碱时,B(OH)m不是强碱,故②错误;
③HnDOm为强酸,但不一定是最高价氧化物对应的水化物,即E的非金属性可能很强,也可能不是很强,故③错误;
④HnCOm为强酸时,C的非金属性较强,非金属性E>D>C,元素的非金属性越强,其单质的氧化性越强,所以E的单质可能有强氧化性,故④正确;
故选:A.
点评 本题考查了元素周期律,明确同一周期元素金属性、非金属性强弱变化规律是解本题关键,再结合元素非金属性强弱与其最高价氧化物的水化物酸性强弱之间的关系分析解答,题目难度不大.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:填空题
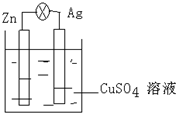 在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,锌片上观察到的现象为锌片溶解;银电极上的电极反应式是Cu2++2e-=Cu,银片上观察到的现象是有红色物质生成.
在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,锌片上观察到的现象为锌片溶解;银电极上的电极反应式是Cu2++2e-=Cu,银片上观察到的现象是有红色物质生成.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙炔、苯、丙炔 | B. | 乙醇、甲酸、乙酸 | ||
| C. | 甲醛、乙酸、葡萄糖 | D. | 丙烯、乙烯、2-戊烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
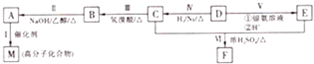
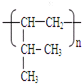
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 应加入的物质 | 所起的作用 | |
| A | ||
| B | ||
| C | ||
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| B. | 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化是一个放热的反应,所以升高温度,反应的速率减慢 | |
| D. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与NaOH溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | 氢氧化铝与稀硫酸反应:OHˉ+H+═H2O | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
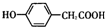 ;
; .
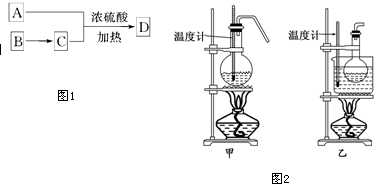
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
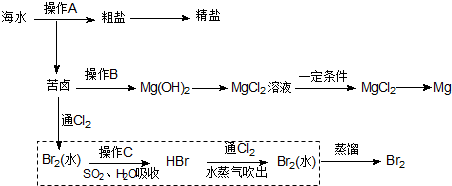
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com