
| A. | 煤油中 | B. | 水中 | C. | 棕色瓶中 | D. | 四氯化碳中 |
科目:高中化学 来源: 题型:解答题
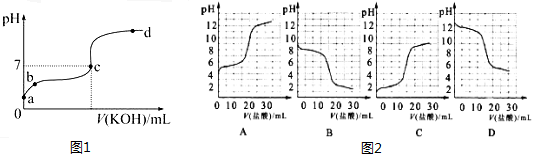
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O
氢氧化镍在乙醇的悬浊液中可发生如下反应生成单质镍的配合物:Ni(OH)2+5CH3NC═(CH3NC)4Ni+CH3NCO+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 应用 |
| A | Na2O2与水、CO2反应 | 潜水艇O2的来源 |
| B | 单质镁有强还原性 | 镁合金作飞机材料 |
| C | 次氯酸及其盐具有漂白性 | 净化饮用水 |
| D | 铜不与O2反应 | 制备铜币 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 该温度下此反应的平衡常数K=1.44 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正) | |
| C. | 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大 | |
| D. | 0~2min的平均速率ν(Z)=2.0×10-3mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
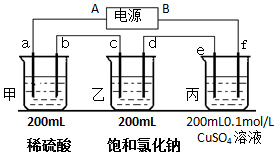 用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则
用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| B. | 标准状况下,11.2 L由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA | |
| D. | 常温常压下,22.4 L的NO2和CO2混合气体含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
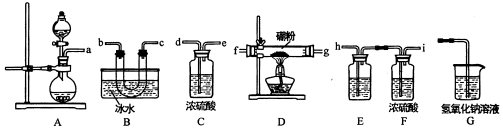
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com