
 如表为元素周期表的一部分.
如表为元素周期表的一部分.分析 由元素周期表中的位置可知①②③④⑤⑥分别为N、F、Na、Al、P、Cl.
(1)⑥为Cl元素;
(2)同周期从左到右,元素的非金属性增强,同主族从上到下元素的非金属性减弱;
(3)同主族元素从上到下原子半径增大,元素的非金属性越强,对应的氢化物越稳定;
(4)氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠和水.
解答 解:由元素周期表中的位置可知①②③④⑤⑥分别为N、F、Na、Al、P、Cl.
(1)⑥为Cl元素,位于周期表第3周期 VIIA族,故答案为:第3周期 VIIA族;
(2)同周期从左到右,元素的非金属性增强,同主族从上到下元素的非金属性减弱,可知位于周期表右上角的元素的非金属性最强,为F元素,故答案为:F;
(3)同主族元素从上到下原子半径增大,N和P相比较,可知N的原子半径较小,N的非金属性较强,元素的非金属性越强,对应的氢化物越稳定,则稳定的为NH3,
故答案为:N;NH3;
(4)氧化铝为两性氧化物,与氢氧化钠溶液反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O,
故答案为:Al2O3+2OH-═2AlO2-+H2O.
点评 本题考查位置、结构、性质的关系,为高频考点,把握元素的位置推断元素及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| R | W | X | |
| Y | Z |
| A. | R、Y、Z的最高价氧化物对应的水化物的酸性依次增强 | |
| B. | R、W和氢三种元素形成的阴离子有2种以上 | |
| C. | RY2分子中每个原子的最外层均为8电子结构 | |
| D. | X和Z氢化物的热稳定性和还原性均依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 操作 | 现象和结论 |
| 将混合气体依次通入D(或B),足量的A,然后通入C | D变黄色(或B褪色),则混合气体有氯气;C变蓝,则混合气体含的氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
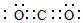 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 火碱 | 蔗糖溶液 | 氯化钠溶液 | NH3•H2O | 三氧化硫 |
| C | 胆矾 | 石灰水 | 硫酸钡 | Al (OH)3 | NH3 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 碘化氢 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将Cl2通入氯化亚铁溶液 Fe2++Cl2═Fe3++2Cl- | |
| B. | 铜与浓硝酸的反应:Cu+4HNO3(浓)═Cu 2++2NO3-+2NO2↑+2H2O | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | Ca(HCO3)2溶液与过量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  与 与  | B. | CH3CH2Cl与CH2ClCH2CH2Cl | ||
| C. | C2H5OH与CH3OH | D. | CH3CH2CH3与CH2=CHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置进行石油的分馏 | |
| B. |  实验室制取乙酸乙酯 | |
| C. |  用图所示装置萃取碘水中的碘 | |
| D. |  检验溴乙烷与NaOH乙醇溶液共热产生乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com