
| A. | 铁丝在氯气中燃烧:Fe+Cl2$\frac{\underline{\;点燃\;}}{\;}$FeCl2 | |
| B. | 常温下,0.1mol/L醋酸溶液pH≈3 CH3COOH?CH3COO-+H+ | |
| C. | 铝片放入氢氧化钠溶液中有气体产生 2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| D. | 蔗糖与浓硫酸混合产生刺激性气味的气体 C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O |
分析 A.不符合反应客观事实;
B.醋酸为弱电解质,部分电离,用可逆号;
C.二者反应生成偏铝酸钠和氢气;
D.浓硫酸具有脱水性和强的氧化性,使蔗糖脱水生成碳,碳与浓硫酸反应生成二氧化硫和二氧化碳和水.
解答 解:A.铁与氯气反应生成氯化铁:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3,故A错误;
B.常温下,0.1mol/L醋酸溶液pH≈3,醋酸电离方程式:CH3COOH?CH3COO-+H+,故B正确;
C.铝片放入氢氧化钠溶液中有气体产生,离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑,故C正确;
D.蔗糖与浓硫酸混合产生刺激性气味的气体,化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故D正确;
故选:A.
点评 本题考查了化学方程式、离子方程式的书写,明确弱电解质电离方式、浓硫酸的性质是解题关键,注意方程式遵循原子个数、电荷数守恒规律,遵循客观事实,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸常温下可与铜片迅速反应生成二氧化硫气体 | |
| C. | 浓硫酸是一种常用的干燥剂,可用来干燥氢气、氨气等 | |
| D. | 浓硫酸具有强氧化性,常温时可使铁、铝钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题:
A.B,C,D,E五种元素,均位于元素周期表的前四周期.它们的核电荷数逐渐增加.且核电荷数之和为57;B原子的L层p轨道中有2个电子,C的原子核外有三个未成对电子,D与B原子的价电子数相同.E原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.请回答下列问题: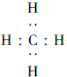 ,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.
,Y中D原子的杂化轨道类型为sp3杂化;C与A形成的常见化合物的分子构型为三角锥形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
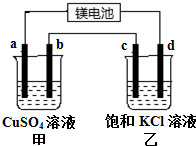 用一种镁二次电池(反应为:xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4)连接甲、乙装置进行电解.如图所示,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出.下列说法不正确的是( )
用一种镁二次电池(反应为:xMg+Mo3S4$?_{充电}^{放电}$MgxMo3S4)连接甲、乙装置进行电解.如图所示,a、b、c均为石墨电极,d为Fe电极,电解时d极有气体放出.下列说法不正确的是( )| A. | 甲装置中a的电极反应为4OH--4e-═O2↑+2H2O | |
| B. | 放电时镁电池正极的电极反应为 Mo3S4+2xe-═Mo3S42x- | |
| C. | 当d极产生0.56 L(标准状况)气体时,b极增重3.2 g | |
| D. | 镁电池放电时,甲池中的SO42-移向a电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在 pH 为 6.37 及 10.25 时,溶液中 c(H2CO3)=c(HCO3-)=c(CO32-) | |
| B. | 反应 HCO3-+H2O?H2CO3+OH-的平衡常数为 10-7.63 | |
| C. | 0.1 mol•L-1NaHC2O4溶液中 c(HC2O4-)+2c(C2O42-)+c(H2C2O4)=0.1 mol•L-1 | |
| D. | 往 Na2CO3溶液中加入少量草酸溶液,发生反应:CO32-+H2C2O4=HCO3-+HC2O4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能说明非金属性Cl>C:2HClO3+CaCO3=Ca(ClO3)2+CO2↑+H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ | |
| D. | 铅酸蓄电池充电时的负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
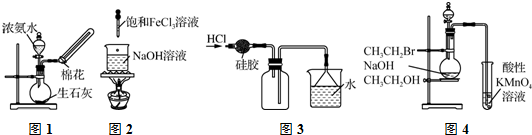
| A. | 利用图1所示装置制取少量NH3 | |
| B. | 利用图2所示装置制备Fe(OH)3胶体 | |
| C. | 利用图3所示装置收集HCl | |
| D. | 利用图4所示装置检验是否生成乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com