
【题目】针对上题,反应开始至2 min,Z的平均反应速率为( )
A. 0.05 mol/(L·s)B. 0.01 mol/(L·s)
C. 0.01mol/(L·min)D. 0.05 mol/(L·min)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是:
a.有氧气生成;b._________。
(2)某学校研究性学习小组拟用下图所示装置进行实验,以证明上述结论。
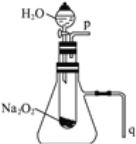
①用以验证结论a的实验操作方法及现象是_________。
②用以验证结论b的实验____________。
(3)该研究性学习小组的同学认为Na2O2和H2O反应可生成H2O2,现请你设计一个简单的实验证明Na2O2和足量的H2O充分反应后的溶液中有H2O2存在。(只要求列出实验所用的试剂及观察到的现象)
试剂:__________。
现象:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.蔗糖和麦芽糖均为双糖,互为同分异构体,均能水解
B.油脂为天然高分子化合物,水解产物之一是甘油
C.植物油含不饱和键,能使溴的四氯化碳溶液褪色
D.淀粉和纤维素水解的最终产物均葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下反应关系:

(1)若B是淡黄色固体,反应②③均用到同一种液态氢化物。D物质常用于食品工业。写出反应④的化学方程式: _________________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出反应③的化学方程式: __________________________________________。
(3)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素位于同一主族,且溶液均显碱性。写出反应②的化学方程式: ___________________________。
(4)若D物质具有两性,反应②③均要用强碱溶液,反应④是通入过量的一种引起温室效应的主要气体。写出反应④的离子方程式: ____________________________________。
(5)若A是应用最广泛的金属。反应④用到A,反应②⑤均用到同一种非金属单质。写出反应④的离子方程式: _____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类利用金属的历史看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事,造成这个先后顺序事实的最主要因素是
A.金属活动性及冶炼的难易程度B.金属的导电性
C.金属的延展性D.地壳中金属元素的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+ H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加炭的量
B.将容器的体积缩小一半
C.保持体积不变,充入一定量的水(g)
D.保持压强不变,充入氮气使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法中正确的是
A. 用CCl4萃取碘水中的碘单质,振荡过程中需进行放气操作
B. 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏高
C. 用碱式滴定管量取25.00mL溴水
D. 用pH试纸测得氯水的pH为2
查看答案和解析>>
科目:高中化学 来源: 题型:
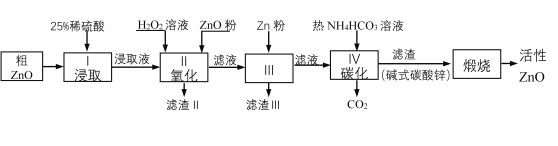
【题目】活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:
已知各相关氢氧化物沉淀pH范围如下表所示:
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要______(选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是____________(用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________。
(4)步骤III中加入Zn粉的作用是:①__________________;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为____________。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
①取1.000g活性氧化锌,用15.00mL 1.000mol·L-1硫酸溶液完全溶解,滴入几滴甲基橙。②用浓度为0.5000mol·L-1的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的依据是_________;所得活性氧化锌的纯度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法不正确的是( )
A.Fe(OH)3胶体制好后可以用渗析的方法进一步净化
B.电泳现象可以证明胶体都带电
C.利用丁达尔效应可以区分溶液和胶体
D.由于胶粒之间有排斥作用,胶粒不易聚集成大的颗粒,这是胶体具有介稳性的主要原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com