
| A. | Ba2+和NO3- | B. | Na+和Cl- | C. | Ag+和SO42- | D. | Na+和NO3- |
科目:高中化学 来源: 题型:实验题

| 物质 | SiCl4 | AlCl3 | FeCl3[来 | FeCl2 |
| 沸点/℃ | 57.6 | 180(升华) | 300(升华) | 1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C5H12属于烷烃且有2种同分异构体 | |
| B. | 乙烯、氯乙烯、甲苯分子中的所有原子均共平面 | |
| C. | C4H10与Cl2在光照条件下反应,可生成4种一氯代烃 | |
| D. | 苯分子中不含碳碳双键,所以不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 标准状况下,22.4LCO2含有的分子数目为NA | |
| C. | 1L1mol•L-1K2SO4溶液中含有的钾离子数目为NA | |
| D. | 1molH2在O2中完全燃烧转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④⑤ | C. | ②④⑤ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
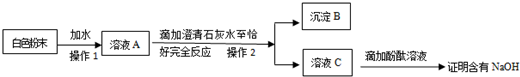
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
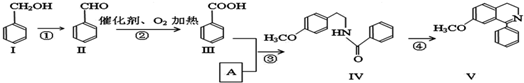
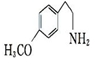 .
.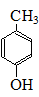 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都属于铵盐 | B. | 都属于离子化合物 | ||
| C. | 互为同素异形体 | D. | 互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | CuSO4 | C. | K2SO3 | D. | Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com