
| A.Na+、Mg2+ | B.Al3+、Mg2+ | C.Mg2+、AlO2- | D.Na+、AlO2- |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:不详 题型:单选题
| A.1 mol铜片与含2 mol H2SO4的浓硫酸共热 |
| B.常温下1 mol铝片投入足量的浓硫酸中 |
| C.1 mol MnO2粉末与含2 mol H2O2的溶液共热 |
| D.常温下1 mol铜片投入含4 mol HNO3的浓硝酸中 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲中产生的沉淀一定比乙中多 | B.乙中产生的沉淀一定比甲中多 |
| C.甲和乙产生的沉淀一定一样多 | D.甲和乙中产生的沉淀可能一样多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中 (填含或不含)有Al(OH)3,请写出有关反应的化学方程式:
,观察到有白色沉淀,继续加过量NaOH溶液,白色沉淀又溶解。你能得出该抗酸药中 (填含或不含)有Al(OH)3,请写出有关反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol·L-1 | B.0.5 mol·L-1 | C.0.6 mol·L-1 | D.0.4 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.24n(A1)+35.5n(Na)=W2—W1 | B.n(Na)+3n(A1)=aV2 |
| C.n(Na)+3n(A1)=V1/11.2 | D.aV2=V1/22.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 签部分表面长出白色毛状物,此白色毛状物的化学式为____, 此物质与氢氧化钠溶液反应的离子方程式为_____。
签部分表面长出白色毛状物,此白色毛状物的化学式为____, 此物质与氢氧化钠溶液反应的离子方程式为_____。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
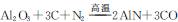 ,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。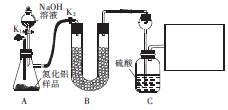
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
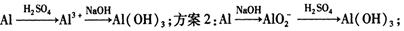
 o
o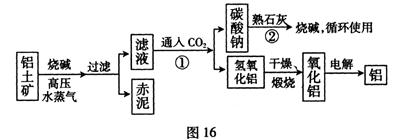
| | Al2O3 | Fe2O3 | 其他杂质 |
| 铝土矿 | 55% | 16% | — |
| 赤泥 | 15% | 48% | 一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com