
(14分) 卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
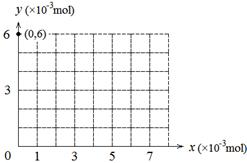
(1)0.006 酸性 (2)② 不能 该反应只能说明I2的还原性比Br2强
(3)BrO3-> IO3-> Br2 > I2 BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O
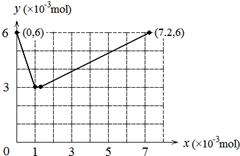
(4) 
解析试题分析:(1)I-被氧化成I2,0.006mol I-被氧化时转移电子数为0.006mol。硫酸表现出的是酸性作用。
(2)ii是KBrO3氧化I2,所以②反应符合。该反应只能说明I2的还原性比Br2强,不能说明碘的非金属性强于溴。
(3)根据氧化剂的氧化性强于氧化产物的氧化性可知氧化性BrO3-> IO3-> Br2 > I2。KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是BrO3-+ 5Br- + 6H+ = 3Br2 + 3H2O。
(4)整个过程发生如下两个反应:①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ②2BrO3-+ I2 = 2IO3-+ Br2,当
KBrO3加入1×10-3mol时I-全部被氧化成I2,当KBrO3加入7×10-3mol时I2全部被氧化成IO3-。所以图像为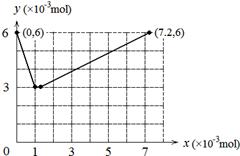 。
。
考点:氧化还原反应
点评:本题主要根据实验的现象来确定反应。


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com