
| A. | 铍(Be)的原子失电子能力比镁弱 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
分析 A.同一主族元素,元素的金属性随着原子序数增大而增强,元素的金属性越强,其失电子能力越强;
B.卤族元素单质都是有色物质,其卤化银中只有AgF能溶于水和稀硝酸;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.元素的非金属性越强,其氢化物的稳定性越强.
解答 解:A.同一主族元素,元素的金属性随着原子序数增大而增强,元素的金属性越强,其失电子能力越强,金属性Mg>Be,所以铍(Be)的原子失电子能力比镁弱,故A正确;
B.卤族元素单质都是有色物质,其卤化银中只有AgF能溶于水和稀硝酸,所以砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸,故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Sr>Ca,所以氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强,故C正确;
D.元素的非金属性越强,其氢化物的稳定性越强,非金属性Se<S,所以硫化氢比硒化氢稳定,故D错误;
故选D.
点评 本题考查元素周期律,为高频考点,明确同一主族元素原子结构和元素周期律关系是解本题关键,知道金属性非金属性强弱判断方法,题目难度不大.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子不可能是烷烃 | B. | 分子中C、H个数之比为1:4 | ||
| C. | 分子中可能含有氧原子 | D. | 此有机物的最简式为CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 结晶氯化钠 | B. | 金刚石 | C. | 碳酸钠 | D. | 二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
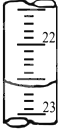 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:| 滴定次数 | 待测液 体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
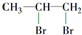 1,2二溴丙烷; ②
1,2二溴丙烷; ②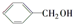 苯甲醇.
苯甲醇. C4H8O; ②
C4H8O; ②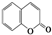 C9H6O2.
C9H6O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变不同 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 单质的氧化性:X2>Y>Z | D. | 原子最外电子层上电子数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com