

| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
分析 由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,由工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,利用溶解度不同进行结晶分离.若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,导致得到的KMnO4产品的纯度降低.
(1)煅烧暴露在空气中煅烧混合物,由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,由电子转移守恒可知,应有氧气参加反应,根据H元素守恒应有水生成,配平书写方程式;
(2)溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3;
(3)电解K2MnO4溶液得到KMnO4,Mn元素发生氧化反应,故溶液中水电离的氢离子放电,发生还原反应生成氢气,同时得到KOH;
由图可知,阳离子由左室通过阳离子交换膜进入右室,故左室为阴极室,右室为阴极室,溶液中生成KOH;
阳离子交换膜防止锰酸根进入阴极区被还原.
解答 解:由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,由工艺流程可知,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,利用溶解度不同进行结晶分离.若通入CO2太多,会生KHCO3,滤液中含有KHCO3、KMnO4,在加热浓缩时,会有KHCO3晶体和KMnO4晶体一起析出,导致得到的KMnO4产品的纯度降低.
(1)煅烧暴露在空气中煅烧混合物,由题目信息,可知二氧化锰与KOH煅烧生成K2MnO4,由电子转移守恒可知,应有氧气参加反应,根据H元素守恒应有水生成,配平后方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O;
(2)溶液中通入二氧化碳与溶液中氢氧化钠反应,调节pH,CO2使MnO42-发生歧化反应,生成MnO4-和MnO2,根据元素守恒可知,会生成K2CO3,有关反应离子方程式为3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,
故答案为:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)电解K2MnO4溶液得到KMnO4,Mn元素发生氧化反应,故溶液中水电离的氢离子放电,发生还原反应生成氢气,同时得到KOH,电解反应方程式为:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
由图可知,阳离子由左室通过阳离子交换膜进入右室,故左室为阴极室,右室为阴极室,溶液中生成KOH,故A溶液应为KOH溶液;
阳离子交换膜防止锰酸根进入阴极区被还原,提高了Mn元素利用率,
故答案为:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;KOH溶液;阳离子交换膜防止锰酸根进入阴极区被还原.
点评 本题考查实验制备方案,涉及化学工艺流程、仪器与试剂选择、对实验条件的控制、电解应用、对题目信息获取与应用等,需要学生具有扎实的基础知识与灵活运用知识解决问题的能力,难度中等.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案科目:高中化学 来源: 题型:选择题
| A. | 铜与浓硫酸反应放出SO2:Cu+4H++SO42-═Cu2++SO2↑+2H2O | |
| B. | 加热NH4Cl和氢氧化钠固体混合物:NH4++OH-═NH3↑+H2O | |
| C. | 稀硝酸与过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2 H2O | |
| D. | 氯气通入FeCl2溶液中:Cl2+2Fe2+═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
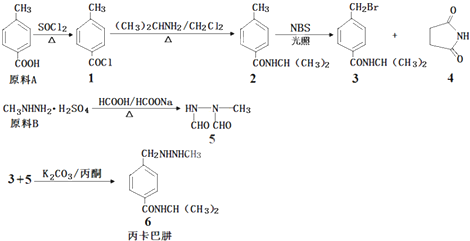
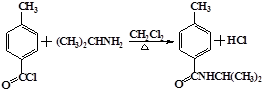 .
.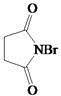 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
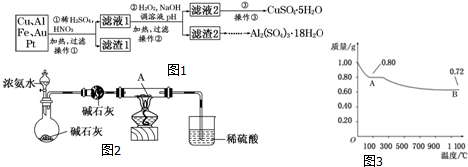
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +C2H5OH$\stackrel{H_{2}SO_{4}}{?}$
+C2H5OH$\stackrel{H_{2}SO_{4}}{?}$ +H2O
+H2O| 沸点(℃) | 密度(g•cm-3) | |
| 苯甲酸 | 249 | 1.2659 |
| 苯甲酸乙酯 | 212.6 | 1.05 |
| 乙醇 | 78.5 | 0.7893 |
| 环己烷 | 80.8 | 0.7785 |
| 乙醚 | 34.51 | 0.7318 |
| 环己烷、乙醇和水共沸物 | 62.1 |



查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “春蚕到死丝方尽,蜡烛成灰泪始干”中的“丝”、“泪”分别是纤维素和油脂 | |
| B. | 乙醇、金属钠和乙酸分别属于非电解质、非电解质和弱电解质 | |
| C. | Na2O2、Al2O3、C4H10分别属于碱性氧化物、两性氧化物和离子化合物 | |
| D. | 煤的气化、石油的分馏分别是化学变化、物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23g乙醇和甲酸的混合物中含有O-H键的数目为0.5NA | |
| B. | 40g SiC中含有Si-C键的数目为2NA | |
| C. | 标准状况下,22.4L乙醛含有分子的数目为NA | |
| D. | 2mol亚油酸(9,12-十八碳二烯酸,C17H31COOH)中含有双键的数目是4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com