
| A. | 该反应中KNO3是氧化剂,N2是还原产物 | |
| B. | 每生成16 mol N2转移30 mol电子 | |
| C. | 若氧化产物比还原产物多1.75mol,则转移电子的物质的量为1.25mol | |
| D. | 该反应中氧化产物与还原产物的质量之比为1:15 |
分析 10NaN3+2KNO3═K2O+5Na2O+16N2↑,NaN3氮元素化由-$\frac{1}{3}$升高到N2中的0价,是还原剂,发生氧化反应,对应氧化产物;2KNO3中氮化合价由+5降低到N2 中的0价,是氧化剂,发生还原反应,对应还原产物,据此解答.
解答 解:A.NaN3中所含的N元素化合价升高,是还原剂,N2是还原产物也是氧化产物,故A错误;
B.根据方程式可知当转移10mol电子时生成N216mol,即每生成16 mol N2转移10 mol电子,故B错误;
C.若氧化产物比还原产物多1.75mol,由反应可知,生成16molN2时氧化产物比还原产物多14mol,则该反应生成氮气为$\frac{16×1.75}{14}$=2mol,转移电子的物质的量为0.25mol×(5-0)=1.25mol,故C正确;
D.该反应中10molNaN3是还原剂,生成氧化产物N2的物质的量是15mol;2molKNO3是氧化剂,生成还原产物N2的物质的量是1mol,氧化产物与还原产物物质的量之比为15:1,故D错误;
故选C.
点评 本题考查了氧化还原反应相关的概念,属于基础知识考查,明确发生的反应及反应中元素的化合价变化即可解答,题目难度不大,.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
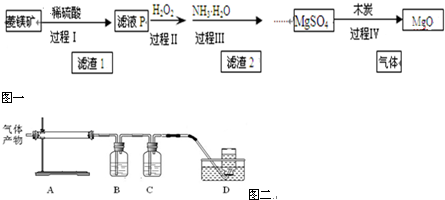
| Mg(OH)2 | Fe(OH)3 | Fe(OH)2 | |
| 开始沉淀的pH | 10.4 | 1.9 | 7.0 |
| 沉淀完全的pH | 12.4 | 3.2 | 9.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

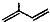 命名为2-甲基-1,3-丁二烯.
命名为2-甲基-1,3-丁二烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知常温下0.1mol•L-1NaHA溶液的pH=9,则:c(Na+)═c(A2-)+c(HA-)+c(H2A) | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| C. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中先滴加NaCl溶液至不再有沉淀生成,继续滴加Na2S溶液,观察到白色沉淀转化为黑色,则溶解度大小关系为:Ag2S>AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及其现象 | 实验结论 |
| A | 取某卤代烃少许与NaOH的乙醇溶液共热,然后将产生的气体通过酸性高锰酸钾溶液,酸性高锰酸钾溶液褪色 | 卤代烃与NaOH的乙醇溶液共热生产了烯烃 |
| B | 向铝制易拉罐中充满CO2,然后向罐内注入足量的浓NaOH,立即用胶布封住罐口,罐壁立即内陷,一段时间后,罐壁又重新鼓起来 | NaOH溶液即可吸收CO2,又可与金属铝反应产生气体 |
| C | 取2mL 0.1mol•L-1 AgNO3溶液,滴入1mL 0.1mol•L-1 KSCN溶液,静置后,向上层清液中滴入FeCl3溶液,溶液变红 | 溶液中仍然有SCN- |
| D | 将在空气中灼烧过的呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变为红色,反复数次,试管中的液体有刺激性气味 | 在此反应中铜丝作催化剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
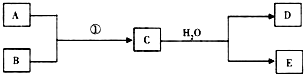 (1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com