
 X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.
X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y与R同族,Y的氢化物常温下为无色无味的液体,X与Y可形成直线形分子XY2,Z的基态原子p轨道上电子总数为7,T2+离子的3d轨道上有3个电子.分析 X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y的氢化物常温下为无色无味的液体,则该氢化物为水,所以Y为O元素;Y与R同族,所以R为S元素;X与O可形成直线形分子XY2,而且X的原子序数比O小,所以X为C元素;Z的基态原子p轨道上电子总数为7,则Z的电子排布为ls22s22p63s23p1,为Al元素;T2+离子的3d轨道上有3个电子,其电子排布式为ls22s22p63s23p63d3,所以原子的电子排布式为:ls22s22p63s23p63d34s2,则T为V元素;结合元素化合物的性质和元素周期律分析解答.
解答 解:X、Y、Z、R、T为前四周期元素,且原子序数依次增大,Y的氢化物常温下为无色无味的液体,则该氢化物为水,所以Y为O元素;Y与R同族,所以R为S元素;X与O可形成直线形分子XY2,而且X的原子序数比O小,所以X为C元素;Z的基态原子p轨道上电子总数为7,则Z的电子排布为ls22s22p63s23p1,为Al元素;T2+离子的3d轨道上有3个电子,其电子排布式为ls22s22p63s23p63d3,所以原子的电子排布式为:ls22s22p63s23p63d34s2,则T为V元素;
(1)R为S元素,其原子核外有16个电子,分三层排布,则其电子排布式为:ls22s22p63s23p4;元素的非金属性越强,其电负性越强,则电负性O>C>S,即O的电负性最强;
故答案为:ls22s22p63s23p4;O;
(2)CO32-离子中C的价层电子对数=3+$\frac{1}{2}$(4+2-3×2)=3,属于sp2杂化;SO2分子中S的价层电子对数=2+$\frac{1}{2}$(6-2×2)=3,含有一个孤电子对,所以立体构型是V形;
故答案为:sp2;V形;
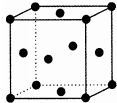
(3)Z为Al元素,其晶胞属于面心立方,则配位数为12;
故答案为:12;
(4)V3+能被酸性KMnO4氧化成VO2+,则其反应的离子方程式为:5V3++MnO4-+H2O=Mn2++5VO2++2H+;
故答案为:5V3++MnO4-+H2O=Mn2++5VO2++2H+.
点评 本题考查位置结构性质相互关系及应用,涉及电子排布式、原子杂化、晶胞、离子方程式等知识点,综合性较强,正确推断元素、物质是解本题关键,同时考查学生知识迁移能力.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:选择题
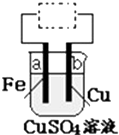 用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )
用铁片(电极a)、铜片(电极b)和CuSO4溶液可以构成原电池或电解池,如图所示.则下列说法正确的是( )| A. | 构成原电池时b极反应为:Cu-2e-═Cu2+ | |
| B. | 构成的原电池或电解池工作后就可能产生大量气体 | |
| C. | 构成电解池时b 极质量既可能减少也可能增加 | |
| D. | 构成电解池时a极质量一定会减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 不锈钢具有较强的耐腐蚀性,纯铁也有较强的耐腐蚀性 | |
| C. | 汽车尾气中氮氧化物的产生主要是由于汽油中含有氮元素而产生的 | |
| D. | 对石油进行分馏可以得到许多苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 操作 | 现象 | 结论 |
| A | 在盛番茄汤的玻璃杯中加入适量植物油,充分搅拌、静置 | 上层溶液颜色比下层更深 | 番茄色素在植物油中的溶解度比在水中小 |
| B | 向浓度均为0.1mol/L的醋酸和硼酸的溶液中分别滴加等浓度Na2CO3溶液 | 前者产生大量气泡,后者无现象 | 酸性强弱顺序:醋酸>碳酸>硼酸 |
| C | 将碳酸氢铵分解产生的气体通入CaC12溶液 | 产生白色沉淀 | CO2与CaC12溶液反应生成CaCO3沉淀 |
| D | 在试管中将某有机物与银氨溶液混合微热 | 产生光亮的银镜 | 该有机物一定是醛类物质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾净水原理为:Al3++3H2O=Al(OH)3↓+3H+ | |
| B. | 该溶液中AlO2-、F-、K+、Na+能大量共存 | |
| C. | 加入过量NH3•H2O反应的离子方程式为:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 加入过量Ba(OH)2溶液反应的离子方程式为:Al3++2SO42-+4OH-+2Ba2+=AlO2-十2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.0gSiO2晶体中存在的共价键总数为2 NA | |
| B. | 1L 0.1mol•L-1的Na2CO3溶液中含有阳离子的总数为2NA | |
| C. | 标准状况下,2.0gD2O中含有的质子数和中子数均为NA个 | |
| D. | 室温时,pH=12的Ba(OH)2溶液中,氢氧根离子数目为10-2N |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A所形成的氢化物常温下一定为气态 | |
| B. | 非金属性:A<E | |
| C. | 元素C、D、E在自然界中均不能以游离态存在 | |
| D. | 元素B的氧化物对应的水化物一定为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com