
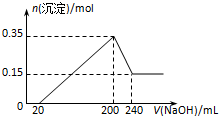
 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )| A. | 镁和铝的总质量为9 g | |
| B. | 最初20 mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为5 mol•L-1 | |
| D. | 生成的氢气在标准状况下的体积为11.2 L |
分析 从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;
当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为硫酸钠,由钠离子守恒:2n(Na2SO4)=n(NaOH),进而计算硫酸的浓度;
当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2.从200mL到240mL,NaOH溶解Al(OH)3,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,故沉淀最大时n[Mg(OH)2]=0.15mol,n[Al(OH)3]=0.35mol-0.15mol=0.2mol,根据Mg、Al守恒计算二者总质量,根据电子转移守恒计算生成氢气体积.
解答 解:从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;
当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为硫酸钠;
当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2.从200mL到240mL,NaOH溶解Al(OH)3,发生反应NaOH+Al(OH)3=NaAlO2+2H2O,故沉淀最大时n[Mg(OH)2]=0.15mol,n[Al(OH)3]=0.35mol-0.15mol=0.2mol.
A.n(Mg)=n[Mg(OH)2]=0.15mol,则m(Mg)=0.15mol×24g•mol-1=3.6g,n(Al)=n[Al(OH)3]=0.35mol-0.15mol=0.2mol,则m(Al)=0.2mol×27g•mol-1=5.4g,所以镁和铝的总质量为3.6g+5.4g=9g,故A正确;
B.由上述分析可知,最初20 mLNaOH溶液用于中和过量的硫酸,故B正确;
C.当V(NaOH溶液)=200mL时,溶液中溶质为硫酸钠,由2n(Na2SO4)=n(NaOH)=0.2L×5mol/L=1mol,则n((Na2SO4)=0.5mol,所以原硫酸溶液的浓度为$\frac{0.5mol}{0.2L}$=2.5mol/L,故C错误;
D.令生成的氢气为xmol,则根据电子转移守恒有2x=0.15×2+0.2×3,解得x=0.45mol,标准状况下V(H2)=0.45mol×22.4L•mol-1=10.08L,故D错误.
故选:CD.
点评 本题以图象题的形式考查镁铝的重要化合物知识、混合物有关计算等,题目难度中等,分析图象各阶段发生的反应是解题关键,掌握守恒法在计算中应用.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏?????????? | B. | 萃取、蒸馏、分液 | ||
| C. | 分液、蒸馏、萃取????????? | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
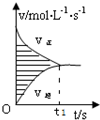 在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )
在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )| A. | 反应起始时,X、Y、Z 三种物质同时存在 | |
| B. | t1 时刻,X、Y、Z 浓度不再发生变化,反应停止 | |
| C. | 若该反应在更大的压强下进行,达平衡时,阴影部分面积不变 | |
| D. | 若该反应在加入催化剂的条件下进行,达平衡时,阴影部分面积不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 18 g重水(D2O)所含的电子数为10NA | |
| C. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.1NA | |
| D. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成56g N2时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| B | 向10mL 0.2mol/L AgNO3溶液中滴入2滴0.1mol/L NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol/LKI溶液 | 白色沉淀转化为黄色沉淀 | 证明在相同温度下的Ksp:AgCl>AgI |
| C | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| D | 把SO2通入橙色的溴水中 | 橙色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol•L-1 | B. | 3mol•L-1 | C. | 3.5mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
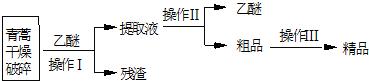
科目:高中化学 来源: 题型:实验题
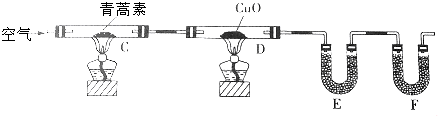
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com