
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
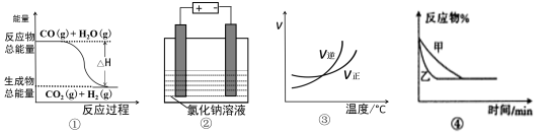
| A. | 图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0 | |
| B. | 图②表示用惰性电极电解足量氯化钠溶液.一段时间后,两极上可收集到相等体积的气体 | |
| C. | 图③表示可逆反应:A2(g)+3B2(g)?2AB3(g)△H<0 | |
| D. | 图④表示压强对可逆反应2A(g)+B(g)?3C(g)+D(s)的影响,乙压强大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作及现象 |
| A | 检验1-溴丙烷中含有溴 | 将1-溴丙烷与足量氢氧化钠溶液混合加热,冷却后加硝酸银溶液,得沉淀 |
| B | 验证样品中一定含有苯酚 | 向样品溶液中滴加氯化铁溶液后显紫色 |
| C | 验证蔗糖没有水解 | 在蔗糖溶液中加入稀硫酸,水浴加热一段时间后,加入少量新制Cu(OH)2悬浊液,加热后未出现砖红色沉淀 |
| D | 证明蛋白质的变性是不可逆的 | 向蛋白质溶液中滴加CuSO4溶液,有固体析出,过滤,向固体中加足量水,固体不溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com