
【题目】氢气是一种常用的化工原料,应用十分广泛。以H2合成尿素CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1
②NH3(g)+![]() CO2(g)=
CO2(g)=![]() NH2CO2NH4(s) △H2=-79.7kJ·mol-1
NH2CO2NH4(s) △H2=-79.7kJ·mol-1
③NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H3=+72.5kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为___。
【答案】N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=179.3kJmol1
【解析】
根据盖斯定律计算。
已知:①N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1
②NH3(g)+![]() CO2(g)=
CO2(g)=![]() NH2CO2NH4(s) △H2=-79.7kJ·mol-1
NH2CO2NH4(s) △H2=-79.7kJ·mol-1
③NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H3=+72.5kJ·mol-1
根据盖斯定律:①+②×2+③,可得N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=92.4+(79.7)×2+72.5=179.3kJmol1。


科目:高中化学 来源: 题型:
【题目】用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸入硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )
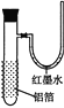
A.铝与硝酸汞反应属放热反应
B.铝是一种较活泼的金属,
C.铝与氧气反应放出大量的热量
D.铝片上生成的白毛是氧化铝和氧化汞的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如图所示:
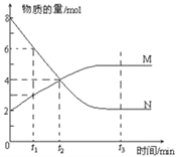
(1)该反应的化学方程式是_____________________________
(2)在图上所示的三个时刻中___________(填t1、t2或t3)时刻处于平衡状态,此时v正________v逆(填>、<或=);达到平衡状态后,平均反应速率v(N):v(M)=___________
(3)若反应容器的容积不变,则“压强不再改变”_________(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是________(选填字母) A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O22SO3(g),经4s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为________;平衡时SO3的物质的量浓度________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A. c(H+)/c(NH4+) B. c(NH3·H2O)/ c(OH-)
C. c(NH4+) c(OH-)/c(NH3·H2O) D. c(H+)c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25mL氢氧化钠标准溶液中逐滴加入0.1mol·L-1的CH3COOH溶液,pH变化曲线如图所示:

(1)该氢氧化钠溶液的物质的量浓度为__。
(2)A点对应的横坐标为25mL,请用离子方程式解释A点所示的溶液显碱性的原因:__。
(3)A点所示的溶液中各离子浓度由大到小的排列顺序是:______。
(4)B点所示溶液中,![]() =___。
=___。
(5)C点所示溶液为等浓度的CH3COONa和CH3COOH混合溶液,请判断该溶液中c(CH3COOH)__c(CH3COO-)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制得氯气并探究氯气的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中。试回答:
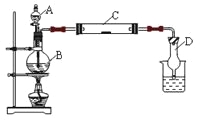
(1)怎样检验装置的气密性_____________________________________;
(2)若C中为淀粉KI试纸,实验片刻后C中可以观察到的实验现象为_______;写出B中发生反应的离子方程式_________________________________________________。
(3)若C中的淀粉KI试纸实验一段时间后又变为无色,原因是__________________。
(4)D的作用是_______________。烧杯中加入的是_____________________。
(5)若实验室暂时无二氧化锰,仍用此装置制取氯气,选用___________药品替代。若实验室暂时无浓盐酸,仍用此装置制取氯气,选用__________________药品替代。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干电池是日常生活中常用的电池,原料为Zn和MnO2。某工厂用软锰矿(含MnO2约70%及杂质Al2O3)和闪锌矿(含ZnS约80%及少量FeS杂质)共同生产。流程如下:
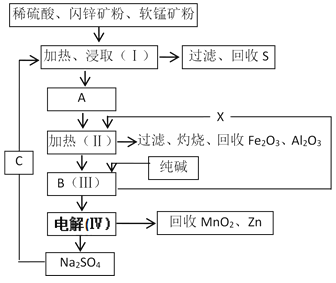
已知:①A是ZnSO4、MnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②Ⅳ中反应的方程式为:MnSO4+ZnSO4+2H2O![]() MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。
(1)混合物A中,属于还原产物的是______(填化学式)。
(2)加入X的作用是_____________________。已知溶液中各离子开始沉淀的pH如表所示,则加入X后,溶液pH应调整到_____(填字母)。
A.4.5 B.8.0 C.6.5 D.9.0
离子 | 开始沉淀pH | 完全沉淀pH |
Fe3+ | 2.3 | 3.2 |
Al3+ | 4.2 | 5.4 |
Zn2+ | 7.2 | 8.0 |
Mn2+ | 8.3 | 9.8 |
步骤Ⅱ加热的原因是____________________。适宜作为X加入步骤Ⅱ的物质为______(填字母)。
A.MnCO3 B.Zn2(OH)2CO3 C.NaOH D.KOH
(3)生产过程中除矿石外,还有哪些原料需要购买?____________(填化学式)。
(4)若要从步骤Ⅳ的过滤中得到芒硝晶体(Na2SO4·10H2O),则需要进行的实验操作有________、________、过滤、洗涤、干燥等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程,既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
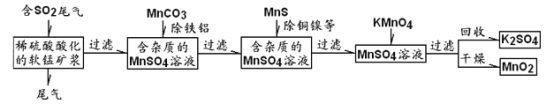
请回答下列问题:
(1)上述流程脱硫实现了______________(选填下列字母编号);
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是___________________;
(3)已知: 25℃、101kpa时,
①Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
②S(s)+O2(g)=SO2(g) △H=-297kJ/mol
③Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是_________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是______。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是________。
(6)KMnO4溶液与MnSO4溶液反应的离子反应方程式是________。
(7)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2_________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表一种元素.

(1)常温下,其单质呈液态的元素是____(填字母代号),它与e形成的化合物电子式为:_____(用元素符号表示)
b元素形成的单质所属品体类型可能是____(填序号)
①分子晶体 ②原子晶体 ③金属晶体 ④离子晶体 ⑤过渡型晶体
(2)元素c、d、g的氢化物的沸点由高到低的顺序为______(用化学式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com