
【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
科目:高中化学 来源: 题型:
【题目】镍具有铁磁性和延展性,能导电和导热。镍单质及其化合物的化学性质与铁相似。
(1)镍易溶于稀的无机酸中,并放出氢气,写出镍与盐酸反应的化学方程式:_____________。
(2)在隔绝空气的条件下,加热NiC2O4使其分解,就能得到暗绿色的氧化亚镍,写出该反应的化学方程式: _____________。
(3)Ni2O3不溶于水,可溶于盐酸并放出氯气,写出该反应的离子方程式: _____________。
(4)氢镍电池是一种碱性可充电电池,污染小,比能量较大。氢镍电池的总反应式是:H2+2NiO(OH) ![]() 2Ni(OH)2。写出放电时的正极反应式: _____________。
2Ni(OH)2。写出放电时的正极反应式: _____________。
(5)纳米材料镍粉(Ni)是一种高性能电极材料,其制备过程如下:
步骤I:取0.2mol/L的硝酸亚镍溶液,调节pH除铁后,加入活性炭过滤。
步骤Ⅱ:向所得滤液中滴加1.5mol/L的NaHCO3溶液使Ni2+完全沉淀,生成:xNiCO3·yNi(OH)2·zH2O。
步骤Ⅲ:将产生的沉淀用大量高纯水清洗并用离心机甩干。
步骤Ⅳ:加入稍过量的肼溶液(N2H4·H2O),使上述沉淀还原完全,将生成的Ni水洗后,再用95%的乙醇浸泡后晾干。为测定xNiCO3·yNi(OH)2·zH2O的组成,进行如下实验:
①准确称取7.54g样品与过量的肼溶液(N2H4·H2O)充分反应,共收集到1.12LN2和CO2的混合气体(已换算成标准状况)。
②另取等质量的样品充分灼烧,冷却后称得残留固体NiO的质量为4.5g。
通过计算确定xNiCO3·yNi(OH)2·zH2O的化学式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 油脂是高级脂肪酸的甘油酯
B. 油脂与氢气发生加成反应,可以得到固态油脂
C. 油脂在酸性或碱性条件下,可以发生皂化反应
D. 油脂没有固定的熔、沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g)△H<0.达到化学平衡后测得A的浓度为0.5molL﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9molL﹣1 . 则下列有关判断正确的是( )
zC(g)△H<0.达到化学平衡后测得A的浓度为0.5molL﹣1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.9molL﹣1 . 则下列有关判断正确的是( )
A.平衡向正反应方向移动了
B.x+y<z
C.B的转化率下降
D.C的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用漂白粉溶液浸泡过的有色布条,如晾晒在空气中,过一段时间,其漂白效果更好的原因是:
A. 漂白粉被氧化了
B. 漂白粉和空气中的二氧化碳充分反应生成了次氯酸
C. 有色布条被空气中的氧气氧化
D. 漂白粉溶液失去了部分水分,浓度增大了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】截至到2013年12月末,中国光伏发电新增装机容量达到10.66GW,光伏发电累计装机容量达到17.16GW。下列左图为光伏并网发电装置,右图为电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。下列叙述中正确的是
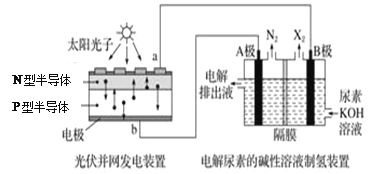
A. 左图中N型半导体为正极,P型半导体为负极
B. 右图溶液中电子流向为从B极流出,从A极流入
C. X2为氧气
D. 工作时,A极的电极反应式为CO(NH2)2+8OH-﹣6e-=CO32-+N2↑+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是
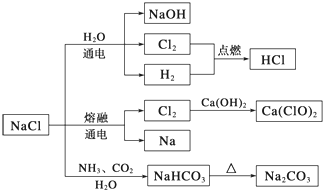
A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是生活中的一种常见金属,用途非常广泛。
(1)FeCl3溶液用于腐蚀铜制印刷电路板,发生反应的离子方程式为___________。
(2)废铁皮制取铁红粉的局部流程图如下:
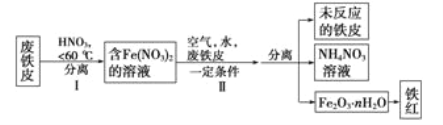
①步骤1温度不能太高的原因是____________________________。
②步骤Ⅱ中发生反应:
4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3
4Fe+10HNO3==4Fe( NO3)2+NH4NO3+3H20
第一个反应的氧化剂是___________,氧化产物是____________。第二个反应每生成1 molNH4NO3,转移的电子数是_________。
③铁红可用于焊接钢轨,其反应的化学方程式为_______________。
④上述生产结束后,流程中氮元素最主要的存在形式为__________(填字母)。
A.氮氧化物 B.硝酸铵 C.硝酸亚铁 D.硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg、Zn、Al混合物与足量稀H2SO4反应,生成H22.8L(标准状况),原混合物质量可能是( )
A. 2g B. 4g C. 10g D. 12g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com