
【题目】若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
科目:高中化学 来源: 题型:
【题目】对于质量相同的CH4和O2,下列说法正确的是 ( )
A.所含分子个数相等 B.物质的量相等
C.所含原子个数之比为5:1 D.体积之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对“摩尔”理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是物质的量的单位,简称摩,符号mol
C.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
D.国际上规定,0.012Kg碳原子所含的碳原子数为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与
与![]() 性质相似,
性质相似, ![]() 与水反应可能有两种,写出可能的方程式:
与水反应可能有两种,写出可能的方程式:
①___________________________
②___________________________
(要求方程式的物质必须用结构式表示,例:H2+Cl2==2HCl可表示为H—H+Cl—Cl ==2H—Cl)试用实验事实判断是哪一种可能?
___________________(提示:AgI是黄色沉淀); ![]() 中Cl 显________价,你的依据是______________;HIO的电子式________________。
中Cl 显________价,你的依据是______________;HIO的电子式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是元素周期表的前四周期:
I A | II A | III A | IV A | V A | VI A | VII A | 0 | |
一 | A | |||||||
二 | B | C | D | E | F | |||
三 | G | H | I | |||||
四 | J |
回答下列问题:
(1)G元素与E元素形成含有非极性键的化合物的化学式是____,I与J的原子序数相差为_____.
(2)上述10种元素的最高价氧化物对应的水化物中,碱性最强的是__(用化合物的化学式表示,下同),酸性最强的是_____,E、F、G三种元素形成的简单离子半径由大到小的顺序是_______(用离子符号回答).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用pH试纸测定某无色溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为正极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阴极一定是阴离子放电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是人体必需的微量元素,铬元素形成的化合物很多,常见的有Cr2O3、(NH4)2Cr2O7、[Cr(CH3COO)2]22H2O等,请回答下列问题:
(1)铬熔点较高,一般应用铝热反应制备铬单质。写出利用Cr2O3制备单质铬的化学方程式 ____________________ 。
(2)实验室常用Fe2+处理含(NH4)2Cr2O7的废水,其流程如下:
Cr2O72﹣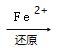 Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
①(NH4)2Cr2O7中铬的化合价为 ________ 。
②第一步的离子方程式为_____ 。
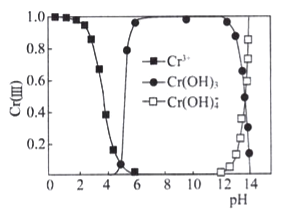
③已知三价铬[Cr(III)]在水溶液中的存在形态随pH的变化如下图,为尽可能除去铬元素实现废水达标排放,pH要控制在_______;若pH过高,溶液中残留铬量增大,其原因是 __________
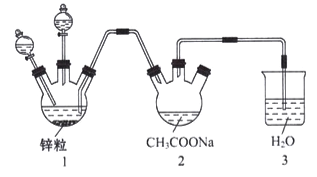
(3)醋酸亚铬水合物{[Cr(CH3COO)2]22H2O,相对分子质量为376} 是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为制备醋酸亚铬水合物,其装置如图所示,且仪器1中预先加入锌粒。
已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
a.Zn+2HCl═ZnCl2+H2↑
b.Zn+2CrCl3═2CrCl2+ZnCl2
c.2Cr2++4CH3COO+2H2O═[Cr(CH3COO)2]22H2O↓
①以上发生的反应中,属于氧化还原反应的是_______(填序号)。
②往仪器1中加入盐酸和三氯化铬溶液的顺序是先加入盐酸一段时间后再加入三氯化铬溶液,然后再加入盐酸。这样做的主要目的是____________________。
③已知其他反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1molL-1实验后得干燥纯净的[Cr(CH3COO)2]22H2O 9.48 g,则该实验所得产品的产率为 __________(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com