
| A. | 稀硝酸与CuO反应 | B. | 稀硝酸与NaOH 溶液反应 | ||
| C. | 浓硝酸与灼热的碳反应 | D. | 浓硝酸与铜反应 |
分析 硝酸表现氧化性,则反应后N元素的化合价降低;表现出酸性,反应物中有硝酸盐生成.
解答 解:A.稀硝酸与CuO反应反应生成硝酸铜和水,化合价没有变化,不是氧化还原反应,硝酸只表现出酸性,故A错误;
B.稀硝酸与NaOH溶液反应生成硝酸钠和水,化合价没有变化,不是氧化还原反应,硝酸只表现出酸性,故B错误;
C.浓硝酸与灼热的碳反应生成二氧化碳、二氧化氮和水,硝酸只表现出强氧化性,故C错误;
D.浓硝酸与铜反应生成硝酸铜、NO和水,N元素化合价降低,硝酸表现出氧化性,生成硝酸铜,硝酸还表现出酸性,故D正确;
故选D.
点评 本题考查硝酸的性质,难度不大,注意根据化合价的变化来判断硝酸酸性与氧化性.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 最外层为2个电子的原子都是金属原子 | |
| B. | 电子能量越低,其运动区域离核越近 | |
| C. | 每个电子层作为最外层时,最多可容纳的电子数均为8 | |
| D. | 从Li到F、从Na到Cl,元素的最高正化合价均呈现从+1到+7价的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 64.0 | 50.653 | 42.875 |
| A | B | C | D | |
| n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
| n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
| n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
| n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | HCl | C. | H2SO4 | D. | KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
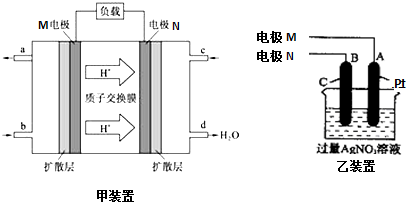
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112mL | B. | 1008mL | C. | 224mL | D. | 448mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18.4mol/L 硫酸 10mL | B. | 2mol/L 硫酸 10mL | ||
| C. | 1mol/L 硫酸 30mL | D. | 3mol/L 盐酸 10mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com