


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
A、NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-
| ||||
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | ||||
| C、酸性高锰酸钾溶液与双氧水反应:2MnO4-+H2O2+6H+═2Mn2++3O2↑+4H2O | ||||
| D、碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH═Ca2++2CH3COO-+2CO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 烧杯中所加的试剂及其用量(mL) | 加入少 量固体 | 溶液褪色 时间(s) | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 1 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| 2 | 15.0 | 15.0 | 10.0 | 无 | 3.6 | |
| 3 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| 4 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
| A、实验3、4说明K+对该反应有催化作用 |
| B、实验2中x=10 |
| C、实验1、2说明反应速率只与KMnO4浓度有关 |
| D、实验1、4可推出实验1中反应速率变化:起初较小,后明显变大,又逐渐变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
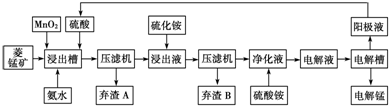
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 |
| 难溶物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某研究性学习小组对铝热反应实验展开研究.现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X2>Y2>Z2>W2 |
| B、Y2>W2>X2>Z2 |
| C、Z2>X2>W2>Y2 |
| D、W2>X2>Z2>Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
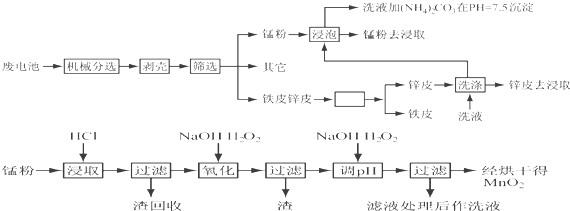
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
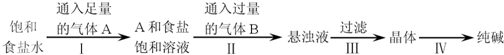
| A、A气体是CO2,B气体是NH3 |
| B、第Ⅲ步得到的晶体是Na2CO3?10H2O |
| C、第Ⅱ步的离子方程式为Na++NH3?H2O+CO2═NaHCO3↓+NH4+ |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com