
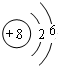 ,
,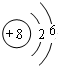 ;
; 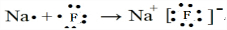 ,D与B形成的化合物为CF4,它的电子式为
,D与B形成的化合物为CF4,它的电子式为 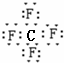 ,
,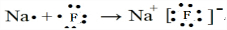 ;
; ;
;


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
| A、10 | B、12 | C、14 | D、21 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度、压强下,固体的体积只由其分子的大小决定 |
| B、一定温度、压强下,气体体积由其物质的量的多少决定 |
| C、等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度相等 |
| D、气体摩尔体积是指1mol任何气体所占的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
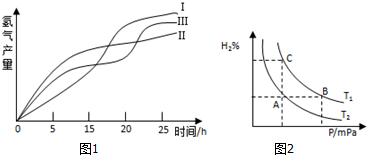
查看答案和解析>>
科目:高中化学 来源: 题型:
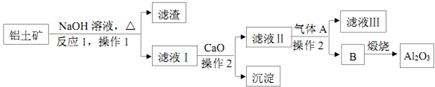
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
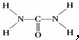 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在溶液中,导电能力弱的电解质不一定是弱电解质 |
| B、强电解质都是离子化合物,弱电解质都是共价化合物 |
| C、纯净的强电解质在液态时,有的导电,有的不导电 |
| D、虽然SO2的水溶液能导电,但是SO2是非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com