
| A. | 用加入适量铜粉再过滤的方法除去Cu(NO3)2溶液中混有的AgNO3 | |
| B. | 向某无色未知溶液中加入氯化钡溶液,以检验溶液中SO42-的存在 | |
| C. | 将CO2 通入盛饱和NaOH溶液的洗气瓶可除去混有的HCl气体 | |
| D. | 只用紫色石蕊试剂和氯化钡溶液,不能将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种溶液鉴别开 |
分析 A.铜与硝酸银反应生成硝酸铜和银,据此可除去Cu(NO3)2溶液中混有的AgNO3;
B.原溶液中可能含有碳酸根离子或银离子,不一定含有硫酸根离子;
C.二氧化碳与氢氧化钠溶液反应;
D.利用紫色石蕊试剂和氯化钡溶液,根据不同的反应现象,能将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种溶液鉴别开.
解答 解:A.铜的还原性大于银,铜与硝酸银发生置换反应,可用铜粉除去Cu(NO3)2溶液中混有的AgNO3,故A正确;
B.向某无色未知溶液中加入氯化钡溶液,若生成沉淀,沉淀可能为氯化银或碳酸钡,无法据此检验溶液中SO42-的存在情况,故B错误;
C.二氧化碳能够与NaOH溶液反应,应该用饱和碳酸氢钠溶液除去二氧化碳中混有的HCl,故C错误;
D.先加入石蕊,盐酸、硫酸溶液呈红色,氢氧化钠溶液呈蓝色,硫酸钠和硝酸钾不变色,然后加入BaCl2溶液,硫酸钠和硫酸分别生成沉淀,可鉴别,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度中等,注意除杂时不能引入新的杂质,更不能影响被提纯的物质,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用托盘天平称量25.20g NaCl | |
| D. | 用25mL碱式滴定管量取碱溶液21.70mL |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备银氨溶液:向2%的氨水中逐滴加入足量的2%的AgNO3溶液 | |
| B. | 除去MgCl2溶液中少量FeCl3:向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌,充分反应后过滤 | |
| C. | 比较Ag2CO3与AgCl溶度积大小:向浓度均为0.1mol•L-1的Na2CO3和NaCl的混合溶液中滴加0.1mol•L-1 AgNO3溶液,观察现象 | |
| D. | 验证Fe3+与I-的反应有一定限度:向5mL0.1mol•L-1KI溶液中滴入0.1mol•L-1FeCl3溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(OH- )=0.1mol•L-1的溶液:K+、SO42-、Na+、Cl- | |
| B. | 能使紫色石蕊试液变蓝的溶液:Ag+、Fe3+、Br-、SO42- | |
| C. | pH═l 的溶液:Na+、Ca2+、HCO3-、ClO- | |
| D. | 与Al反应能放出H2的溶液:Fe2+、Ba2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)/c(OH?)=1的无色溶液中:Fe3+、NH4+、Cl?、SO42? | |
| B. | 使甲基橙呈黄色的溶液中:Na+、ClO?、SO42?、I? | |
| C. | 0.1 mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
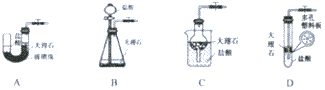
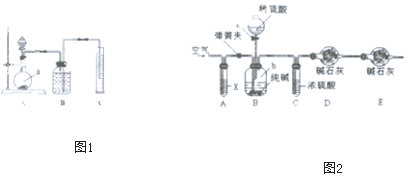
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+ H+ SO42- HCO3- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、NH4+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
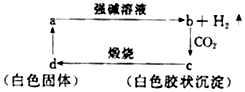
| A. | a在与强碱溶液的反应中氧化剂是强碱 | |
| B. | 向b中滴加适量盐酸可得到c | |
| C. | c不一定是两性物质 | |
| D. | d一定能和氢氧化钠溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com