
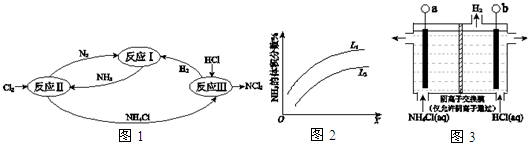
分析 (1)升高温度,平衡向吸热的方向移动;增大压强,平衡向气体体积缩小的方向移动;
(2))①根据流程图,反应II中氯气与氨气反应生成氮气和氯化铵;
②设1molH-N键能为x,1molH-Cl键能为y,根据△H=反应物键能之和-生成物键能之和计算;
(3)①阴极与电源负极相连,阳极与电源正极相连;
②阴极电极反应为氢离子得电子生成氢气,用总反应减掉阴极反应得阳极反应;
(4)根据氧化还原得失电子守恒配平反应.
解答 解:(1)N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1为放热反应,若升高温度平衡逆向移动,前期的体积分数减小,与图象矛盾;若增大压强,平衡向正向移动,氨气的体积分数增大,故改变条件为压强;压强相同时,温度升高,平衡逆向移动,氨的体积分数减小,L1<L2,故答案为:压强;L1<L2;合成氨的反应是放热反应,压强相同时,温度升高,平衡逆向移动,氨的体积分数减小;
(2))①根据流程图,反应II中氯气与氨气反应生成氮气和氯化铵,反应为:8NH3+3Cl2=N2+6NH4Cl,故答案为:8NH3+3Cl2=N2+6NH4Cl
②设1molH-N键能为x,1molH-Cl键能为y,根据△H=反应物键能之和-生成物键能之和,-462=6x+3×243-(945+6y),x-y=41kJ,故答案为:41;
(3)①b极产生氢气,为阴极,与电源负极相连,故答案为:负;
②阴极电极反应为氢离子得电子生成氢气,用总反应减掉阴极反应得阳极反应式,故答案为:3Cl--6e-+NH4+=NCl3+4H+;
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,根据氧化还原化合价升降原理,Cl元素化合价有升高和讲点,根据得失电子守恒配平反应,故答案为:NCl3+6ClO2-+3H2O=6ClO2+NH3+3Cl-+3OH-.
点评 该题考查化学反应速率和化学平衡问题,要求正确书写方程式,学生需有扎实的基础,试题难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中的阳离子只能是金属离子 | |
| B. | 离子化合物中一定含有离子键 | |
| C. | 离子化合物都能溶于水,其水溶液可以导电 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
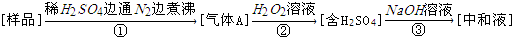
| A. | 亚硫酸盐作为食品添加剂作用是防腐、抗氧化 | |
| B. | 反应①中通入N2的作用是将生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核反应发电实现了化学能到电能的转化 | |
| B. | 115 号元素一定是处于VA 族的非金属元素 | |
| C. | 117 号元素与F、Cl、Br、I 均处于VIIA 族 | |
| D. | 四种新元素位于元素周期表中的不同周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
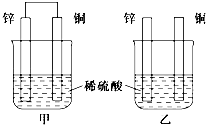 (1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按下图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

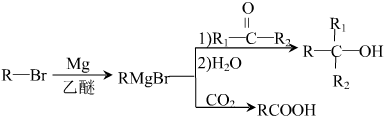
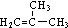 ,D分子中最多有8个原子共平面.
,D分子中最多有8个原子共平面.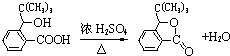 (写明反应条件).
(写明反应条件).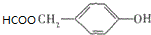 .
.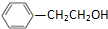 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com