
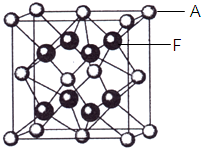
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.| m |
| V |
| ||
| 5-3 |
| 2 |
| ||
| 1 |
| 8 |
| 1 |
| 2 |
| 312 |
| NA |
| 312 |
| aNA |
| 312 |
| aNA |


科目:高中化学 来源: 题型:
| A、0.5 mol Al与足量盐酸反应转移电子数为1.5NA |
| B、标准状况下,11.2 L SO3所含的分子数为0.5NA |
| C、0.1 mol CH4所含的电子数为16NA |
| D、46 g NO2和N2O4的混合物含有的分子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 对于反应CO(g)+H2O(g)?H2(g)+CO2(g)
对于反应CO(g)+H2O(g)?H2(g)+CO2(g)| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

 +R′-M′gX→
+R′-M′gX→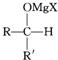
| H+/H2O |
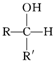 (R,R′均为烃基)
(R,R′均为烃基)查看答案和解析>>
科目:高中化学 来源: 题型:
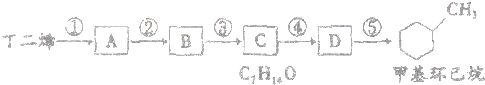
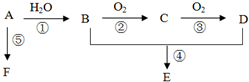 已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为28的气态烃,它可转化为其他常见有机物,转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、③④⑤ | C、②③ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com