
| A. | 外观澄清、透明 | B. | 胶体粒子直径在1~100nm之间 | ||
| C. | 能产生丁达尔现象 | D. | 外观澄清、不透明 |
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量的HCl | B. | 适量的NaCl | C. | 适量的氨水 | D. | 适量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(CO${\;}_{3}^{2-}$)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| C. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | c(Na+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,氯气的密度约为3.17g/L | |
| B. | 密闭容器中的氯水放置数天后,pH变小且几乎失去漂白性 | |
| C. | 液氯具有漂白性,干燥的氯气和液氯均能使干燥的有色布条褪色 | |
| D. | 在通常情况下,氯气可以和某些金属直接化合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
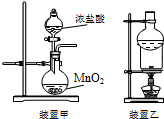
| A. | 用装置甲可以制备氯气 | |
| B. | 用装置乙分离泥沙中的碘单质 | |
| C. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| D. | 用玻璃棒蘸取NaClO溶液点在pH试纸上,测定溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| B | 氯气中混有氯化氢气体 | 洗气 | 氯气和氯化氢在饱和食盐水中溶解度不同 |
| C | 除去苏打中少量小苏打 | 加热 | 二者的溶解度不同 |
| D | 分离CCl4和碘的混合溶液 | 升华 | CCl4和碘沸点相差较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com