
【题目】下列说法中正确的是
A.元素的第一电离能越大,其金属性越强
B.原子核外的 M层上的 s能级和 p能级都填满了电子,而 d轨道上尚未排有电子的两种原子,其对应元素不一定位于同一周期
C.元素电负性越大的原子,失电子能力越强
D.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
科目:高中化学 来源: 题型:
【题目】用50 mL 0.5 mol/L的盐酸与50 mL 0.5 mol/L的NaOH 溶液在下图所示的装置中进行中和热测定实验,下列说法不正确的是
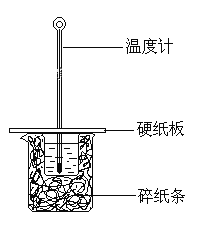
A.图中实验装置缺少环形玻璃搅拌棒,烧杯间填满碎纸条的主要作用是固定小烧杯
B.稀溶液中:H+ (aq) + OH— (aq) = H2O (l) ΔH=-57.3kJ·mol-1 ,若将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3kJ
C.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
D.若改用55 mL 0.50 mol/L的盐酸跟50 mL0.5 mol/L的NaOH溶液进行实验,从理论上说所求中和热相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭的容器中加入N2(g)和H2(g),发生反应N2(g)+3H2(g)2NH3(g) △H<0在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是( )

A.t0-t1B.t2-t3
C.t3-t4D.t5-t6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是
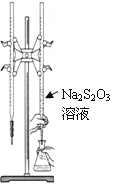
A. 该滴定可用甲基橙做指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定可选用右图所示装置
D. 该反应中每消耗2mol Na2S2O3,电子转移数为4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子的最外层电子数与原子序数的关系如图所示,下列说法正确的是 ( )
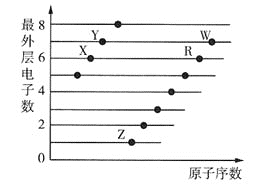
A.X、Y、Z、R、W五种元素的最高正化合价均等于其族序数
B.同周期元素中,W的电负性最大,Z的第一电离能最大
C.R、W所形成的氧化物的水化物的酸性强弱为![]()
D.X、Y、R、W四种元素形成的简单氢化物中最稳定的是Y的简单氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的分子式为![]() ,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为
,A属于第ⅥA族元素,B属于第ⅦA族元素,A和B在同一周期,它们的电负性分别为![]() 和
和![]() ,已知
,已知![]() 分子的键角为
分子的键角为![]() 。下列推断不正确的是
。下列推断不正确的是 ![]()
![]()
A.![]() 分子的空间构型为V形
分子的空间构型为V形
B.![]() 键为极性共价键,
键为极性共价键,![]() 分子为非极性分子
分子为非极性分子
C.![]() 分子中A原子采取
分子中A原子采取![]() 杂化
杂化
D.![]() 分子中无H原子,分子间不能形成氢键
分子中无H原子,分子间不能形成氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液的酸碱度,AG=![]() 。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是

A. D点溶液中的pH=11.25
B. B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积小于20.00 mL
D. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于新材料及3D打印技术,科学家研制出一种微胶囊吸收剂能将工厂排放的CO2以更加安全、廉价和高效的方式处理掉,球形微胶囊内部充入Na2CO3溶液,其原理如图所示。

(1)这种微胶囊吸收CO2的原理是_____________(用离子方程式解释),此过程是_______(填“吸收”或“放出”)能量的过程。
(2)在吸收过程中关于胶囊内溶液下列说法正确的是_____________。
a.吸收前溶液中c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
b.吸收过程中,体系中所有的含碳微粒是CO32-、HCO3-、H2CO3
c.当n(CO2):n(Na2CO3)=1:3时,溶液中c(CO32-)<c(HCO3-)
d.溶液中始终有c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
(3)将吸收的CO2催化加氢可制得乙烯。
已知:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H=-127.8 kJ/mol,如图曲线a表示在体积为2 L的恒容容器中,投料为1 mol CO2和3 mol H2时,测得温度对CO2的平衡转化率的影响,改变投料比测量后得到曲线b。
C2H4(g)+4H2O(g)△H=-127.8 kJ/mol,如图曲线a表示在体积为2 L的恒容容器中,投料为1 mol CO2和3 mol H2时,测得温度对CO2的平衡转化率的影响,改变投料比测量后得到曲线b。

①根据曲线a计算250℃时该反应的化学平衡常数K=_____________(带入数值列出计算式即可)
②b条件下投料比n(H2)/n(CO2)______3(填“>”、“<”或“=”),判断依据是____________________________
③下列说法正确的是_____________。
a.平衡常数大小:M=M1> N
b.其他条件不变,b条件时增加催化剂用量,则250℃时CO2的平衡转化率可能达到M
c.当压强、混合气体的密度或n(H2)/n(CO2)不变时均可视为化学反应已达到平衡状态
d.工业生产中采取较高温度(250 ℃左右)是为了提高催化剂活性加快反应速率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com