
| A.元素周期表中有8个主族 | B.稀有气体元素原子的最外层电子数均为8个 |
| C.碳元素位于第二周期ⅣA族 | D.ⅠA族全是金属元素 |
科目:高中化学 来源:不详 题型:单选题
| A.酸性强弱: HI > HBr > HCl > HF | B.原子半径大小: Na > S > O |
| C.碱性强弱: KOH > NaOH > LiOH | D.还原性强弱: F- > Cl- > I- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol—1 | I1 | I2 | I3[来源:] | I4[来源: |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
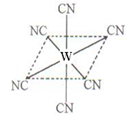
 键数目为 。
键数目为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在元素周期表中,s区,d区和ds区的元素都是金属 |
| B.在元素周期表中,每个纵列的价电子层的电子总数一定相等 |
C.某基态原子错误的核外电子排布图为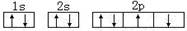 ,该排布图违背了泡利原理 ,该排布图违背了泡利原理 |
| D.在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.③④⑤⑦⑧⑨ | B.③⑥⑦⑧ | C.③⑥⑦⑧⑨ | D.①②③④⑤⑥⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.排布在K、L、M三个电子层上 | B.3p能级上有2个空轨道 |
| C.共有16种不同的运动状态 | D.共有5种不同的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径 Na<Mg<Al | B.热稳定性 HCl>H2S>PH3 |
| C.酸性强弱 H2SiO3<H2CO3<H3PO4 | D.熔点 NaCl>Na>CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.质子数:c>d | B.离子的还原性:Y2->Z- |
| C.氢化物的稳定性:H2Y>HZ | D.原子半径:X<W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com