
| ʵ�� | �� | �� | �� |
| ��ʼͶ�� | 2molH2��1molCO | 1mol CH3OH | 4molH2��2molCO |
| ƽ��ʱn��CH3OH �� | 0.5mol | n2 | n3 |
| ��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
| ��ϵ��ѹǿ | P1 | P2 | P3 |
| ��Ӧ���ת���� | ��1 | ��2 | ��3 |
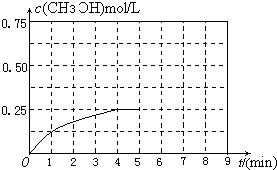
| 1mol |
| 2L |
| 2mol |
| 2L |
| 0.5mol |
| 2L |
| 0.25 |
| 0.25��0��52 |
| 1-a |
| 1 |
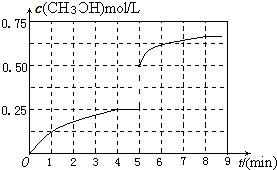 ��
�� ��
��

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
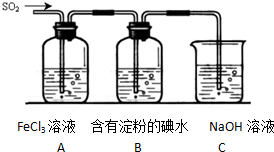
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
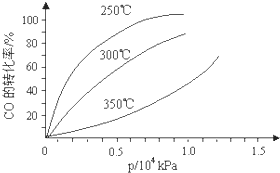 CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��?CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H
CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��?CH3OH��g����CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� | |||
| �� | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������ԭ��Ӧ�У�һ��Ԫ�ػ��ϼ�������һ������һ��Ԫ�ػ��ϼ��½� |
| B�������ᡢ���ˮ�����ֱ������ᡢ��� |
| C���Ӵ����������У�Ϊ���SO2��ת���ʣ��Ӵ����ڷ�Ӧ�¶�ѡ����400�桫500�� |
| D��ij����ֻ����һ��Ԫ�أ�������ʿ���Ϊ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��H+��I-��NO3-��SiO32- |
| B��K+��SO42-��Cu2+��NO3- |
| C��Ag+��Fe3+��Cl-��SO42- |
| D��NH4+��OH-��Cl-��HCO3- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com