
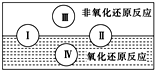
 Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
Ⅰ.已知水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用右图表达:请写出有水参加的符合反应类型Ⅳ的一个化学方程式:
| ||
4- 2 |
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| A、根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| B、根据同周期元素的非金属性变化趋势,推出O元素的非金属性比N元素弱 |
| C、根据主族元素最高正化合价与族序数的关系,推出氧族元素最高正价都是+6 |
| D、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中CO2+SO2+3OH-=HSO3-+CO32-+H2O |
| B、向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓ |
| C、向Fe(NO3)3溶液中加入过量的HI溶液 2NO3-+8H++6I-=3I2+2NO↑+4H2O |
| D、将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32 g O2占有的体积约为22.4 L |
| B、22.4 L N2含阿伏加德罗常数个氮分子 |
| C、在标准状况下,22.4 L水的质量约为18 g |
| D、22 g二氧化碳与标准状况下11.2 L HCl约含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com